问题
填空题
下图是A、B两种固体物质的溶解度曲线图,请回答下列问题:
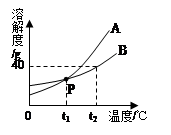
(1)P点表示的含义是 。
(2)在其他条件不变的情况下,若把t1℃时A、B的饱和
溶液分别升温至t2℃,此时两种溶液中溶质的质量分数
关系为A B(填“>”、“<”或“=”)。
(3)t2℃时,将30 g B物质加入50 g水中,所得溶液是 (填“饱和”或“不饱和”)溶液,所得溶液的质量为 g。
答案
(1)在t1oC时,A、B的溶解度相等;(2)=;(3)饱和 ;70g;
题目分析:(1)交点P点表示在这一温度下,两物质的溶解度相等;(2)因为升温时两物质的溶解度变大,溶液均变成不饱和溶液,溶质质量分数不变,故仍然相等;(3)t2℃时,B的溶解度为40g,50 g水中只能溶解20gB,所得溶液饱和,其质量为50g+20g=70g。
