问题
填空题
已知X、Y、Z、W四种元素分布在元素周期表中的三个不同短周期元素里,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、Z原子最外层电子数之和.Y的氢化物分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍.试推断:
(1)写出X、Y的元素符号:X______、Y______;
(2)W在元素周期表中的位置是______;Z的原子结构示意图______
(3)由X、Y、Z所形成的离子化合物的化学式是______,它与W的最高价氧化物的水化物的溶液反应时的离子方程式是______;
(4)用电子式表示Y的氢化物的形成过程______.
答案
Z原子最外层电子数是次外层电子数的3倍,核外各层电子数目分别为2、6,应为O元素,Y的氢化物分子中有3个共价键,说明最外层电子数为5,且Y、Z为同周期的相邻元素,则Y为N元素,W原子的质子数等于Y、Z原子最外层电子数之和,则W的质子数为5+6=11,应为Na元素,所以X应为H元素,则
(1)X为H元素,Y为N元素,故答案为:H;N;
(2)W为Na元素,原子核外有3个电子层,最外层电子数为1,则应位于第三周期ⅠA族,Z为O元素,原子核外有2个电子层,最外层电子数为6,则原子结构示意图为
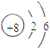
,
故答案为:第三周期IA族;
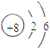
;
(3)常见由X、Y、Z所形成的离子化合物为NH4NO3,与NaOH溶液反应生成NH3•H2O,反应的离子方程式为NH4-+OH-=NH3•H2O,
故答案为:NH4NO3;NH4-+OH-=NH3•H2O;
(4)NH3为共价化合物,用电子式表示的形成过程为
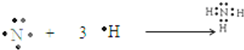
,
故答案为:
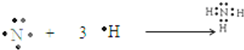
.
