现有10种元素的性质、数据如下表所列,它们均为短周期元素.
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 0.102 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
(1)D的元素名称是______,H的元素符号是______.
B在元素周期表中的位置是(周期、族)______
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是______.
化合物F2A2的电子式是:______,构成该物质的化学键类型为______
(3)用电子式表示A的简单氢化物的形成过程如下:______;G的氢化物的结构式为______.
(4)一定条件下,IA2气体与足量的A单质充分反应生成20g气态化合物,放出24.6kJ热量,写出其热化学方程式______.
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:______.
从图表数据可知,+1价的C、F,一定是碱金属Li和Na,而原子半径F>C,故C应为IA族第二周期的Li,F为三周期的Na元素,J为H元素;D和G最高正价均为+5,负价一致,故为VA族元素,因原子半径D>G,故D为第三周期第VA族的P元素,G为N元素;从化合价可推出E属于卤素,由于短周期F元素无正价,故E为氯元素,位于第VIIA族第三周期;H最高正价+3价,无负价,只能是IIIA族元素,而原子半径H>F,故H只能是位于第二周期第IIIA族的B元素;A和I的最低负价都为-2价,I最高正价为+6价,则A应为第二周期的O元素,I为第三周期的S元素.
(1)由以上分析可知,D为P元素,F为B元素,B为Mg元素,位于第三周期ⅡA族,故答案为:磷;B;第三周期 第ⅡA族;
(2)以上元素中,非金属性最强的元素为Cl元素,对应的最高价氧化物的水化物的为HClO4,酸性最强,化合物F2A2为Na2O2,为离子化合物,含有离子键和非极性共价键,
故答案为:HClO4;
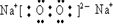
;离子键、非极性键;
(3)A的简单氢化物为H2O,用电子式表示的形成过程为

,G的氢化物为NH3,其结构式为
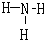
,
故答案为:

;
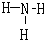
;
(4)IA2气体与足量的A单质充分反应为2SO2+O2

2SO3,
n(SO3)=
=0.25mol,20g 80g/mol
生成2molSO3放出的热量为:24.6kJ×8=196.8 kJ,
反应的热化学方程式为2SO2 (g)+O2(g)

2SO3(g);△H=-196.8 kJ/mol,
故答案为:2SO2 (g)+O2(g)

2SO3(g);△H=-196.8 kJ/mol;
(5)碱性氢氧燃料电池中,负极发生氧化反应,氢气得电子生成氢氧根离子,电极反应式为H2-2e-+2OH-═2H2O,
故答案为:H2-2e-+2OH-═2H2O.
