(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.黄血盐(亚铁氰化钾,K4[Fe(CN)6] )易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾。
回答下列问题:
(1)写出基态Fe2+的核外电子排布式 。K4[Fe(CN)6] 中Fe2+与CN-两种离子之间的作用力是 。
(2)CN-中碳原子的杂化方式为 ;1molCN-中含有π键的数目为 。
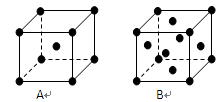
(3)金属钾、铜的晶体的晶胞结构如下图(请先判断对应的图),钾、铜两种晶体晶胞中金属原子的配位数之比为 。
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为 。
(1)1s22s22p63s23p63d6或[Ar]3d6 (2分) 配位键(2分)
(2)sp杂化(2分) 2NA个(2分)
(3)2:3(2分)
(4) K4Fe(CN)6 + 6H2SO4 + 6H2O  2K2SO4 + FeSO4+3(NH4)2 SO4
2K2SO4 + FeSO4+3(NH4)2 SO4
+6CO↑(2分)
(1)根据构造原理可写出其核外电子排布式。氮原子中含有孤电子对,铁中含有空轨道,所以通过配位键。
(2)CN-是直线型结构,采取sp杂化。因为三键是由1个δ键和2个π键构成的。
(3)铜属于面心立方最密堆积结构,对应B图,则钾对应A图,属于体心立方堆积,其配位数分布为12和8,钾、铜两种晶体晶胞中金属原子的配位数之比为2:3。
(4)与CN-是等电子体的气态化合物应该是氮气或CO,因为是非氧化还原反应,所以只能是CO。
