在软件开发项目中,关键路径是项目事件网络中(),组成关键路径的活动称为关键活动。下图中的关键路径历时()个时间单位。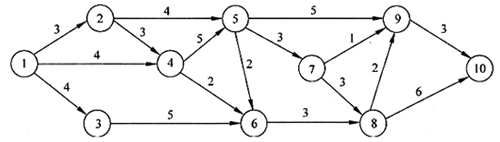
A.14
B.18
C.23
D.25
参考答案:C
解析:
图论中给出了关键路径的定义,即源点到汇点的最长路径为关键路径。
关键路径的识别与计算:
方法一:通过观察法可识别出关键路径为1-2-4-5-7-8-10,此历时最长的路径的历时为3+3+5+3+3+6=23。
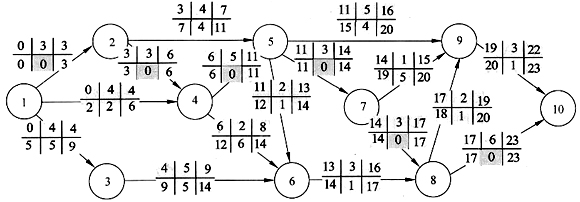
方法二:计算出此双代号网络图的六标识,即最早开始ES、最早结束EF、历时Du、最迟开始LS、最迟结束LF、总时差TF。用正推法计算ES、EF,用倒推法计算LF、LS;TF=LS-ES=LF-EF,总时差为0的活动一定在关键路径上。同样可识别出关键路径为1-2-4-5-7-8-10。
识别出关键路径后,将关键路径上的活动历时相加,即可得到关键路径的历时为23。

 H2(g)+CO2(g),反应过程中测定的部分数据见下表:
H2(g)+CO2(g),反应过程中测定的部分数据见下表:
 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。