电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收Na2Cr2O7等物质。
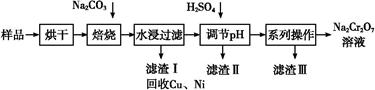
已知:在Na2CrO4溶液中含有少量NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈 性(填“酸”、“碱”或“中”)。
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式。
Cr(OH)3+ Na2CO3+ 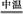 Na2CrO4+ CO2+
Na2CrO4+ CO2+
(3)滤渣Ⅱ的主要成分有Zn(OH)2、 。
(4)“系列操作”中为:继续加入H2SO4, ,冷却结晶,过滤。继续加入H2SO4目的是 。
已知:①除去滤渣II后,溶液中存在如下反应:
2CrO42—+2H+ Cr2O72—+H2O
Cr2O72—+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
| 温度 溶解度 化学式 | 20 ℃ | 60 ℃ | 100 ℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
(1)碱
(2)4Cr(OH)3+4Na2CO3+3O2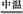 4Na2CrO4+4CO2+6H2O
4Na2CrO4+4CO2+6H2O
(3)Al(OH)3
(4)蒸发浓缩 促进平衡2CrO42—+2H+ Cr2O72—+H2O向正反应方向移动,尽可能生成更多溶解度更大的Na2Cr2O7
Cr2O72—+H2O向正反应方向移动,尽可能生成更多溶解度更大的Na2Cr2O7
(5)CrO42—+8H++6e- Cr+4H2O
Cr+4H2O
(1)水浸后溶液中含碳酸钠,碳酸根水解显碱性;
(2)空气中的氧气氧化Cr(OH)3且和Na2CO3反应生成Na2CrO4,根据H元素守恒Cr(OH)3中的H会生成H2O,然后根据化合价升降总数相等配平化学方程式。
(3)根据水浸后溶液中存在Al、Zn元素,加入硫酸调节pH会生成Zn(OH)2、Al(OH)3沉淀。
(4)根据表格中数据知Na2CrO4比Na2Cr2O7溶解度小,故应加入硫酸使Na2CrO4转化成Na2Cr2O7,Na2SO4在温度较低时溶解度小更容易结晶析出,故采用蒸发浓缩、冷却结晶、过滤分离Na2SO4。
(5)CrO42—得电子生成Cr,O2-结合H+生成H2O。
