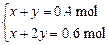问题
计算题
(1)样品中硫元素与铁元素的物质的量之比。
(2)样品化合物的成分是什么?
(3)样品中化合物的物质的量各为多少?
答案
(1)3∶2(3分)
(2)FeS和FeS2(3分)
(3)FeS为0.2 mol(3分),FeS2为0.2 mol(3分)
(1)n(SO2)= ="0.6" mol,41.6 g样品中含铁的质量为m(Fe)=" 41.6" g-0.6 mol×32 g·mol-1="22.4" g,n(Fe)=
="0.6" mol,41.6 g样品中含铁的质量为m(Fe)=" 41.6" g-0.6 mol×32 g·mol-1="22.4" g,n(Fe)= ="0.4" mol,
="0.4" mol,
n(S)∶n(Fe)="0.6" mol∶0.4 mol=3∶2。
(2)因1∶1<3∶2<2∶1,故该样品为FeS和FeS2的混合物。
(3)设FeS、FeS2的物质的量分别为x、y,则有