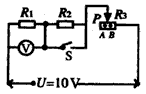
镁在空气中燃烧除生成MgO外,还可能生成Mg3N2。某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成。
(1)甲组同学取一定量燃烧后的固体投入水中,得到了一种能使湿润的红色石蕊试纸变蓝 的气体,该气体的化学式为 ,说明固体中含有Mg3N2,生成该气体的化学反应方程式为 。
(2)乙组同学为测定Mg3N2含量,用图示装置进行实验,充分反应后再加热A。其中浓硫酸的作用是 ,对A加热的目的是 。已知加入的固体质量为4.0g,最终C装置增重ag,则固体中含Mg3N2 g(用含a的式子表示)。
(3)丙组有的同学认为乙组同学的测定结果偏高,理由是
。
有的同学认为乙组同学的测定结果偏低,理由是
。
丙组同学进行了改进,他们将乙组同学实验中得到的难溶固体进行过滤、洗涤、干燥,并
灼烧固体至恒重,测得其质量为4.08g。上述过程中,洗涤沉淀的操作是
。
镁在空气中燃烧后生成的固体中Mg3N2的质量分数为 。
(4)有一种用铵盐与含镁矿石混合煅烧制取氧化镁的方法,解决了现有方法存在的原料成 本高、项目投资大、能耗高、副产品不好用等问题,其原理是将含镁矿石粉(含氧化镁)与 铵盐混合,经过煅烧、水溶、过滤,得到粗镁盐溶液,并回收煅烧产生的氨。写出用固体(NH4)2SO4与含镁矿石粉煅烧的化学反应方程式
。
(1)NH3(1分) Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3↑(1分)
(2)吸收生成的NH3(1分)
将装置A中反应产生的NH3全部驱赶到装置C中(1分)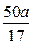 (2分)
(2分)
(3)C装置的两侧无干燥装置,NH3中的水蒸气以及外部空气中的水蒸气都可能进
入C装置而被浓硫酸吸收,造成结果偏高(2分)可能有部分NH3滞留在装置内没有完全被浓硫酸吸收,从而造成结果偏低(2分) 向过滤器中的沉淀上加蒸馏水至完全浸没沉淀,待水全部流出后,重复操作2~3次(2分)10%(2分)
(4)(NH4)2SO4+MgO MgSO4+2NH3↑+H2O(2分)
MgSO4+2NH3↑+H2O(2分)
燃烧后的固体中含MgO和Mg3N2两种物质,Mg3N2与水反应生成Mg(OH)2,经灼烧,
固体最终全部变成MgO
Mg3N2 → 3 MgO △m(固体增重)
100g 120g 20g
m(Mg3N2) 0.08g
100g:20g= m(Mg3N2):0.08g, 解得m(Mg3N2)=0.4g
故镁在空气中燃烧后生成的固体中Mg3N2的质量分数为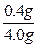 ×100% =10%
×100% =10%