(10分)
I、为了探究HClO的漂白性,某同学设计了如下的实验。
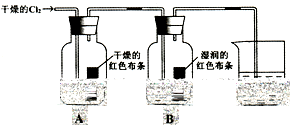
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是 。
(2)从集气瓶B中湿润的红色布条的现象可得出的结论是______________。
(3)烧杯中发生反应的化学方程式是_________________________________。
II、(1)正常雨水显酸性,其pH约值等于5.6,这是由于 。
(2)某次采集的硫酸工业产区酸雨样品,每隔一段时间测定一次pH值,得数据如下
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.6 | 4.3 | 4.2 | 4.0 | 4.0 |
(2分/空,共10分)
(1)干燥的氯气没有漂白性
(2)HClO具有漂白性(或答潮湿的Cl2具有漂白性)
(3) Cl2+2NaOH=NaCl+NaClO+H2O
II、 (1) 显酸性的原因是 CO2+H2O H2 CO3
H2 CO3
(2) SO2+H2O H2 SO3 , 2H2 SO3+ O2= 2H2 SO4(或回答SO2溶于雨水后,被不断氧化为H2 SO4)
H2 SO3 , 2H2 SO3+ O2= 2H2 SO4(或回答SO2溶于雨水后,被不断氧化为H2 SO4)
I、(1)通入Cl2后,从集气瓶A中干燥的红色布条不褪色,可得出的结论是干燥的氯气没有漂白性
(2)从集气瓶B中湿润的红色布条褪色,可得出的结论是HClO具有漂白性(或答潮湿的Cl2具有漂白性)
(3)烧杯中发生反应的化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O
II、(1)正常雨水显酸性,其pH约值等于5.6,这是由于二氧化碳溶于水得到碳酸的缘故。
(2)酸雨的形成主要是二氧化硫溶于水形成亚硫酸的缘故,放置酸雨一段时间,pH值变小的主要原因是亚硫酸氧化为硫酸的缘故,酸性增强,PH减弱。
