问题
填空题
(6分)在下图所示的装置A中,用KMnO4固体和浓盐酸混合制取Cl2,反应的离子方程式为:2MnO4—+10Cl—+16H+=2Mn2++5Cl2↑+8H2O;装置B中的四处棉花依次做了如下处理:①蘸有淀粉—KI溶液②蘸有品红溶液③蘸有紫色石蕊溶液④蘸有浓NaOH溶液。(图中夹持装置已略去)。
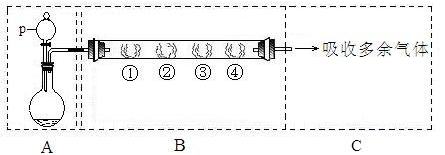
回答下列问题:
(1)p中盛装试剂的名称为 。
(2)反应开始后,观察到的实验现象是:
①处: ;
②处: ;
③处: 。
(3)写出④处反应的离子方式: 。
答案
(6分)(1)分液漏斗(1分
(2)①处:变蓝 (1分)
②处:褪色 (1分)
③处:(1分) 先变红后褪色(1分)
(3)Cl2+2OH—=Cl—+ClO-+H2O (2分)
考查氯气的制取及性质
(1)p装置为分液漏斗
(2)①处:Cl2+2I-=I2+2Cl-,碘使试纸呈蓝色
②处:氯气与水生成了具有漂白性的次氯酸:Cl2+H2O=HCl+HClO,故品红将褪色
③处:氯气与水生成了盐酸,使紫色石蕊试液变红,但迅速将被次氯酸漂白而褪色
(3)由于氯气有毒,必须进行尾气吸收,一般用碱液:Cl2+2OH—=Cl—+ClO-+H2O
