A、B、C、D、E为五种元素的单质,其余为化合物。其中只有E为金属元素,五种元素的原子序数按B、D、C、A、E顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系:

请回答下列问题:
(1)下面是周期表的一部分,请将A、C、E用元素符号填在相应的位置上。
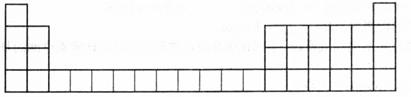
(2)写出实验室制取A反应的离子方程式_______________。
(3)戊的分子式为_______。B与D形成的原子个数比为2:1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式______。
(4)A与丙常温下发生反应生成甲与单质D,该反应的化学方程式_________。
(5)8gE在A中燃烧放出热量QkJ,写出该反应热化学方程式________(热量是常温下测定的)。
(6)实验室配制庚溶液的实验方法是________。
(1)
| O | |||||||||||||||||
| Cl | |||||||||||||||||
| Fe |
(2)MnO2 + 4H+ + 2Cl― Mn2+ + Cl2↑ + 2H2O
Mn2+ + Cl2↑ + 2H2O
(3)HClO 
(4)3Cl2 + 2NH3= N2 + 6HCl
(5)2Fe(s) + 3Cl2(g)  FeCl3(s),△H = -14 Q kJ·mol-1
FeCl3(s),△H = -14 Q kJ·mol-1
(6)向盐酸中加入适量的FeCl2晶体,搅拌溶解,然后加水稀释,并加入少许铁粉。
试题解析:根据B可与A、C、D生成化合物甲、乙、丙,原子序数按B、D、C、A、E依次增大,且乙、丙为10电子分子,可判断B为H2。结合C与丙反应生成乙,且乙可与A单质反应,推断出C为O2,D为N2,则乙为H2O,丙为NH3。结合A可与乙(H2O)反应,且产物戊光照可得C(O2)和甲,可推出A为Cl2,戊为HClO,甲为HCl。A(Cl2)与E反应生成己,己又可与E反应生成庚,可推出E为变价金属Fe,己为FeCl3,则庚为FeCl2。
(2)实验室用MnO2和浓盐酸反应制取氯气。
(3)H2与N2形成的原子个数比为2:1的化合物为N2H4。
(4)根据Cl2与NH3反应生成N2和HCl,可写出方程式。
(5)8gFe与Cl2反应放出QkJ热量,即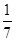 molFe可放出QkJ热量,据此可写出热化学方程式,注意题中强调热量在常温下测定,常温下Fe和FeCl3均为固体。
molFe可放出QkJ热量,据此可写出热化学方程式,注意题中强调热量在常温下测定,常温下Fe和FeCl3均为固体。
(6)实验室配制FeCl2溶液时,为防止Fe2+水解,需将FeCl2晶体在盐酸中溶解,然后稀释,并加适量铁粉。
