在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花。给试管加热,观察现象。当试管中的液体逐渐透明时,停止加热。回答下列问题
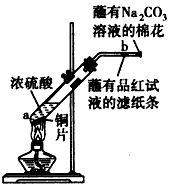
(1)写出a处反应的化学方程式,并标明电子转移的方向和数目________________
(2)试管中的液体反应一段时间后,b处滤纸条的变化为____________________。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为________________
(3)待试管中的液体冷却后,将试管上层液体倒去,再慢慢加入少量水,可观察到溶液呈_______色。
(4)玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是_______________________,反应的化学方程式为___________________
(5)如果浓硫酸的浓度为18 mol/L,铜片是过量的,加热使之反应,被还原的硫酸为0.9 mol,则浓硫酸的实际体积_______ (填写“大于”、“等于”或“小于”)100 mL。
(1)
(2)滤纸条褪色;滤纸条变红
(3)蓝
(4)吸收二氧化硫,防止污染;Na2CO3+SO2=Na2SO3+CO2↑
(5)大于

