问题
实验题
某同学利用铁与水蒸气反应后的固体物质进行了如下实验:
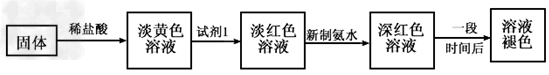
(1)固体溶于盐酸的化学方程式为________________;
(2)试剂1的化学式是____________;加入试剂1后呈红色的原因是(用离子方程式表示):_________________。
(3)加入新制氯水后溶液红色加深的原因是(用离子方程式表示):_____________。
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?

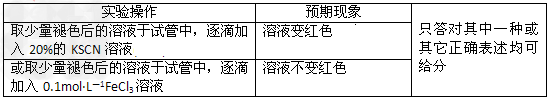
为验证乙同学的猜想是合理的,请你根据此结论完成下表的实验设计方案。可选用试剂:浓硫酸、1.0mol·L-1 HNO3、1.0mol·L-1盐酸、1.0mol·L-1 NaOH溶液、0.1mol·L-1 FeCl3溶液、0.1mol·L-1 CuSO4溶液、20%KSCN溶液、蒸馏水。

答案
(1)Fe3O4 + 8HCl =2FeCl3 + FeCl2 + 4H2O
(2)KSCN , Fe3+ + 3SCN- = Fe(SCN)3
(3)2Fe2++Cl2 = 2Fe3++2Cl-
(4)丁的猜想是:溶液中的+3 价铁被氧化为更高的价态