(10分)工业上用固体硫酸亚铁制取Fe2O3,反应原理是: 2FeSO4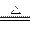 Fe2O3 +SO2↑+SO3↑某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量(已知SO2沸点为- 10. 02℃)
Fe2O3 +SO2↑+SO3↑某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量(已知SO2沸点为- 10. 02℃)
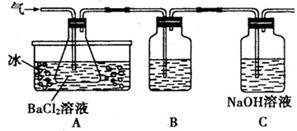
请回答相关问题:
(1)Fe2O3俗称为 不溶于水而易溶于酸,Fe2O3与稀盐酸反应的离子方程式为
(2)A瓶所盛试剂的作用是 C瓶所盛试剂的作用是
,用冷水冷却的原因是 ;B瓶所盛的试剂是
(3)将此反应生成的气体通入A瓶的BaCI2溶液中,下列说法正确的是 (填编号)
A.析出BaSO3沉淀
B.析出BaSO4沉淀
C.逸出SO3气体
D.逸出SO2气体理由是
(4)在用固体硫酸亚铁制取Fe2O3的反应中,还原产物是 ,标准状况下每生成11. 2L SO2气体,转移电子的物质的量为 mol.
(1)铁红;Fe2O3 +6H+ =Fe3++3H2O
(2)检验并吸收SO3; SO3与H2O反应放出大量的热;品红溶液;吸收SO2
(3)B、D;SO3溶予水形成H2SO4,H2SO4与BaCl2反应生成BaSO4,SO2在冰水中溶解度小,与BaCl2不反应
(4) SO2;1
