(13分)某校化学兴趣小组对课本实验结论“葡萄糖与新制氢氧化铜共热生成红色的Cu2O沉淀”提出质疑,认为红色沉淀不一定就是氧化亚铜。为了确定红色沉淀的成分,开展了相关探究。
[一]提出猜想,请你完成猜想2、3。
猜想1、红色沉淀可能是Cu;
猜想2、 ;
猜想3、 。
[二]查阅资料:①Cu20属于碱性氧化物②Cu+在酸I生条件下能发生自身氧化还原反应
[三]制备红色沉淀:①制备氢氧化铜悬浊液②氢氧化铜悬浊液与葡萄糖共热③过滤、洗涤、低温烘干得红色粉末
[四]红色沉淀成分探究:该小组同学设计了三种方案:
方案Ⅰ:取该红色粉末溶于足量稀硝酸中,观察溶液颜色变化。
方案Ⅱ:取该红色粉末溶于足量稀硫酸中,观察是否有残渣。
方案Ⅲ:装置如图所示:(夹持仪器略去)
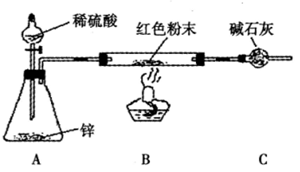
试回答下列问题:
(1)请分别评价方案I和方案Ⅱ是否合理(填“是”或“否”),并完成相关反应方程式:
方案I: ,写出Cu20与稀硝酸反应的化学方程式 ;
方案Ⅱ: ,写出反应的离子方程式 。
(2)实际上,方案Ⅲ的装置尚存在明显的缺陷,应在A和B之问添加 。
(3)方案Ⅲ中,探究小组的同学在锥形瓶中加入少量硫酸铜溶液,其目的是 。
(4)方案Ⅲ中,若要测定红色粉末的成分,需要测定下列哪些物理量 (填序号)。
①反应前红色粉末与硬质玻璃管的总质量 ②实验前干燥管的质量 ③实验后干
燥管的质量 ④硬质玻璃管的质量 ⑤锌粒质量 ⑥稀硫酸的物质的量浓度
[一]提出猜想:猜想2、红色沉淀可能是Cu2O;(1分)
猜想3、红色沉淀可能是Cu2O和Cu的混合物(1分)。
[四]红色沉淀成分探究(1)方案I:否,(1分)3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O(2分)
方案Ⅱ: 否,(1分)Cu2O+2H+=" Cu+" Cu2++H2O(2分)
(2)干燥装置(1分),(3)形成铜锌原电池,加快反应,(2分),(4)①②③④(2分)
本题考查化学实验的探究、设计、评价、数据处理等知识,对学生的能力要求较高。根据中学所学知识及猜想1知:猜想2是红色沉淀可能是Cu2O;猜想3是红色沉淀可能是Cu2O和Cu的混合物;方案I的设计不合理,因为无论是Cu2O或Cu或二者混合物都可被硝酸溶解,现象相同,方案Ⅱ设计也不合理,因为Cu2O或Cu或二者混合物溶于足量稀硫酸中,都有残渣,方案Ⅲ的原理是利用反应前红色粉末与硬质玻璃管的总质量减去硬质玻璃管的质量求红色粉末的质量,实验前后干燥管的质量求水的质量,从而求Cu2O的质量,若m(H2O)=0,则不含Cu2O,若红色粉末的质量=Cu2O的质量,则不含Cu,若红色粉末的质量大于Cu2O的质量,则是Cu2O和Cu的混合物,因此方案Ⅲ应在A和B之间加干燥装置,以吸收氢气中的水,防止造成干扰。方案Ⅲ中,在锥形瓶中加入少量硫酸铜溶液,其目的是形成铜锌原电池,加快反应。
