(15分)氰化物有剧毒,冶金工业会产生大量含氰化物的废水,其中氰化物以CN—等形式存在于废水中。某化学小组同学对含氰化物废水处理进行研究。
I.查阅资料:含氰化物的废水破坏性处理方法。
利用强氧化剂将氰化物氧化为无毒物质,如以TiO2为催化剂用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。
II.实验验证:破坏性处理CN-的效果。
化学兴趣小组的同学在密闭系统中用图10装置进行实验,以测定CN-被处理的百分率,实验步骤如下:
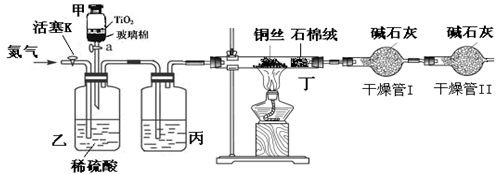
步骤1:取一定量废水进行加热蒸发、浓缩。
步骤2:取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)倒入甲中,塞上橡皮塞。
步骤3:
步骤4:打开甲上的橡皮塞和活塞,使甲中溶液全部放入乙中,关闭活塞。
步骤5:打开活塞K,通一段时间N2,关闭活塞K。
步骤6:实验完成后测定干燥管I(含碱石灰)的质量m2(实验前干燥管I(含碱石灰)的质量m1)
回答下列问题:
(1)在破坏性处理方法中,在酸性条件下NaClO和CNO-反应的离子方程式 。
(2)完成步骤3 。
(3)丙装置中的试剂是 ,丁装置的目的是 。
(4)干燥管Ⅱ的作用是 。
(5)请简要说明实验中通入N2的目的是 。
(6)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为 。
(1)2CNO—+6ClO—+8H+=2CO2↑+N2↑+Cl2↑+4H2O (2分)
(2)点燃酒精灯对丁装置加热(2分) (3)浓硫酸;除去Cl2(各2分)
(4)防止空气中的水和CO2进入干燥管I中影响对CO2的测量(2分)
(5)使装置中的CO2全部到干燥管I中被吸收,减少误差。(2分) (6)80%(3分)
(1)次氯酸钠具有强氧化性,能把CNO—氧化生成氮气和CO2,所以反应式为2CNO—+6ClO—+8H+=2CO2↑+N2↑+Cl2↑+4H2O。
(2)由于需要通过加热的铜丝吸收氯气,所以应该先点燃丁处的酒精灯。
(3)因为生成的气体需要干燥,所以丙装置中应该盛放浓硫酸,干燥CO2气体。
(4)干燥管I是吸收CO2的,因此为了防止空气中的水和CO2进入干燥管I中影响对CO2的测量,需要再连接1个干燥管。
(5)由于装置中会残留部分CO2,所以通入氮气的目的是使装置中的CO2全部到干燥管I中被吸收,减少误差。
(6)干燥管Ⅰ中碱石灰增重1.408g,则反应中生成的CO2是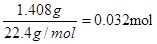 ,所以CNO—的物质的量是0.032mol。CN-的总的物质的量是0.04mol,所以根据原子守恒可知,该实验中测得CN-被处理的百分率为80%。
,所以CNO—的物质的量是0.032mol。CN-的总的物质的量是0.04mol,所以根据原子守恒可知,该实验中测得CN-被处理的百分率为80%。
