电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,不符合电解要求,因此必须经过精制。某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器。
(2)步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为________________。
(3)步骤2中,判断加入BaCl2已过量的方法是:___________________________。
(4)步骤2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是_________________。
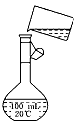
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的两处错误是: ________________、________________。若在定容时仰视,则所配溶液的浓度
______0.2 mol/L(填“大于”或“小于”);若定容不慎超过刻度线,应采用的处理方法是___________________________。
(1)玻璃棒;漏斗
(2)NaOH→BaCl2→Na2CO3(或BaCl2→NaOH→Na2CO3)
(3)取所得溶液的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变混浊,则表明
BaCl2已过量
(4)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
(5)未用玻璃棒引流;未采用150 mL容量瓶;小于;重新配制
