下图Ⅰ、II、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回求答下列问题:
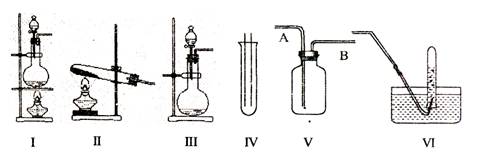
(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2,则可选择 ;(填序号)
若用NH4Cl和Ca(OH)2反应制NH3,则可选择 ;(填序号)
若用MnO2与浓盐酸反应制取氯气,应选用装置 ,(填序号)用离子方程式表示制取氯气的反应原理是 。
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从 口通入。用化学方法检验氯气收集满的方法是 。
(3)气体的吸收:若经试验发现,现1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3,则所得溶液中溶质的物质的量浓度为 mol/L。
(1)III;II;I;MnO2 + 4H+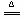 Mn2+ + Cl2 + 2H2O;(2)A;用湿润的碘化钾淀粉试纸靠近B口,试纸变为蓝色,证明氯气已集满;(3)10.5。
Mn2+ + Cl2 + 2H2O;(2)A;用湿润的碘化钾淀粉试纸靠近B口,试纸变为蓝色,证明氯气已集满;(3)10.5。
(1)若用CaCO3与盐酸反应制CO2,由于该反应的特点为反应不加热且固体+液体→气体,则可选择装置Ⅲ;若用NH4Cl和Ca(OH)2反应制NH3,由于该反应的特点为反应需要加热且固体+固体→气体,则可选择II;若用MnO2与浓盐酸反应制取氯气,由于该反应的特点为反应需要加热且固体+液体→气体,应选用装置Ⅰ;(2)由于氯气的密度比空气的大,利用装置Ⅴ收集氯气,则应由A管口进气;依据氯气的性质,可用湿润的碘化钾淀粉试纸靠近B口,试纸变为蓝色,证明氯气已集满;(3)设在标准状况下1L的水吸收336L的HCl气体,则所得溶液中溶质的物质的量浓度为: =10.5 mol/L。
=10.5 mol/L。