(18分)下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。
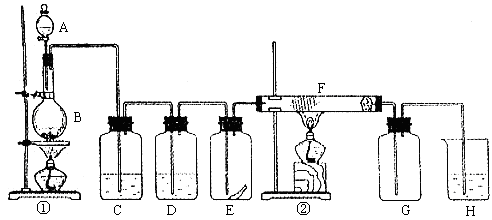
试回答:
(1)A试剂为 ,B试剂为 ,离子方程式为 ;
(2)C试剂为 ;D试剂作用为 ;
(3)E中干燥红色布条 (填“褪色”或“不褪色”);
(4)F管中现象 ,脱脂棉的作用是 ;
(5)H中试剂为 ,离子方程式为 。
(18分) (1)浓盐酸 (1分);MnO2 (1分);MnO2+4H++2Cl-- Mn2++Cl2↑+2H2O(2分);
Mn2++Cl2↑+2H2O(2分);
(2)饱和食盐水 (2分);吸水氯气中的水蒸气 (2分)
(3)不褪色 (2分);
(4)棕黄色的烟 (2分);防止CuCl2固体小颗粒被气体鼓入导管中,堵塞导管 (2分)
(5)NaOH溶液 (2分) Cl2+2OH-=Cl-+ClO-+H2O(2分)
题目分析:根据题中所给出的信息可知本实验是室制取纯净、干燥的Cl2,并进行检验Cl2性质实验。(1)依据课本所学制备氯气用的是浓盐酸和固体MnO2的加热反应。所以,A为浓盐酸,B为MnO2,离子方程式为MnO2+4H++2Cl-- Mn2++Cl2↑+2H2O。(2)由①中生成氯气,氯气通到C中出去挥发出的HCl气体,除去HCl气体有饱和食盐水,因此C为饱和食盐水;氯气从C中通入到D中进行干燥出去氯气的水蒸气,D中是浓硫酸。(3)氯气从D中出来后是干燥的氯气,通到E中,干燥的氯气不能漂白,因此E中的干燥布条不褪色。(4)已知F中是铜网,在加热的条件下,氯气与Cu发生反应,生成棕黄色的烟。脱脂棉的作用是为了防止防止CuCl2固体小颗粒被气体鼓入导管中,堵塞导管,影响氯气的搜集。(5)氯气是有毒气体,所以H中是吸收多余气体的NaOH溶液,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
Mn2++Cl2↑+2H2O。(2)由①中生成氯气,氯气通到C中出去挥发出的HCl气体,除去HCl气体有饱和食盐水,因此C为饱和食盐水;氯气从C中通入到D中进行干燥出去氯气的水蒸气,D中是浓硫酸。(3)氯气从D中出来后是干燥的氯气,通到E中,干燥的氯气不能漂白,因此E中的干燥布条不褪色。(4)已知F中是铜网,在加热的条件下,氯气与Cu发生反应,生成棕黄色的烟。脱脂棉的作用是为了防止防止CuCl2固体小颗粒被气体鼓入导管中,堵塞导管,影响氯气的搜集。(5)氯气是有毒气体,所以H中是吸收多余气体的NaOH溶液,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
点评:氯气的制备,性质的检验是常考查的知识点,对于实验流程分析透彻,本题考查的内容全部源自课本。
