A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应又能和烧碱反应;⑥F与C同主族.用化学符号或化学用语回答下列问题:
(1)用电子式表示下列物质A2C2______,DCA______;
(2)用电子式表示D与F形成化合物的过程______;
(3)用“化学式”和“<或>”比较:A与C、A与F形成化合物的稳定性______;沸点的高低______,沸点高低的原因______;
(4)写出E与烧碱反应的离子方程式______.
(1)因A2C2是H2O2,是共价化合物,电子式为:
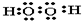
;DCA是NaOH,是离子化合物,电子式为

,故答案为:
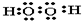
;

;
(2)Na2S是2个钠原子和1个硫原子通过离子键形成的,形成过程为
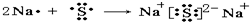
,
故答案为:
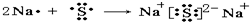
;
(3)元素的非金属性越强,形成的氢化物越稳定;分子间键使物质的熔、沸点升高,
故答案:H2O>H2S;H2O>H2S;H2O分子间存在氢键;
(4)铝能够与碱反应生成偏铝酸盐和氢气:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
