在某温度下、容积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2SO2(g)+O2(g)

2SO3(g)△H=-196kJ/mol.初始投料与各容器达平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molSO21molO2 | 2molSO3 | 4molSO22molO2 |
| 平衡时n(SO3) | 1.6mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
(2)该温度下此反应的平衡常数值为______,若在相同温度条件下起始投入0.1molSO2、0.1molO2、0.3molSO3,则反应开始时正逆反应速率的大小关系是V正______V 逆
(3)三个容器中的反应分别达平衡时各组数据关系正确的是______
A.α1+α2=1 B.Q1+Q2=196 C.α3<α1
D.P3<2P1=2P2E.n2<n3<3.2mol F.Q3=2Q1
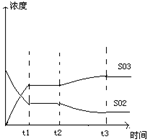
(4)如图表示甲反应在t1时刻达到化学平衡,在t2时刻因改变某个条件而发生变化的情况,则t2时刻改变的条件可能是______或______.
(1)若初始投入amolSO2、bmolO2和cmolSO3,在相同条件下,要达到与甲相同的化学平衡,
则amolSO2、bmolO2和cmolSO3相当于2molSO2和1molO2,达到同一平衡状态,
则 2SO2(g)+O2(g)

2SO3(g)
状态1:2mol 1mol 0
状态2:amol bmol cmol
则应有a+c=2,b+
=1,c 2
故答案为:a+c=2; b+
=1;c 2
(2)达到平衡时,平衡时n(SO3)=1.6mol,
则 2SO2(g)+O2(g)

2SO3(g)
起始:2mol 1mol 0
转化:1.6mol 0.8mol 1.6mol
平衡:0.4mol 0.2mol 1.6mol
则:k=
=c2(SO3) c2(O2)×c2(SO2)
=80,1.62 0.42×0.2
若在相同温度条件下起始投入0.1molSO2、0.1molO2、0.3molSO3,
则Qc=
=90>80,平衡向逆反应方向移动,则正反应速率小于逆反应速率,0.32 0.12×0.1
故答案为:80;<;
(3)甲容器反应物投入2molSO2、1molO2与乙容器反应物投入2mol SO3在保持恒温、恒容情况下是等效平衡,平衡时SO3的物质的量n2=1.6mol、p1=p2、α1+α2=1、Q1+Q2能量总变化相当于2molSO2、1molO2完全转化成2mol SO3的能量,即吸放热Q1+Q2数值上就等于196kJ;甲容器反应物投入量2molSO2、1molO2与丙容器反应物投入量4molSO22molO2,若恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡,然而现在是温度、容积相同的3个密闭容器,我们可以当成是在恒温且容积是甲容器两倍条件下,体积受到了压缩,原反应正向气体体积减少,由平衡移动原理,则相较于甲容器(或假设状况)而言,丙容器平衡向逆向移动,也就是说,丙容器的转化率比甲容器还要低一些.
因此α1+α2=1、Q1+Q2=196;α3>α1;P3<2P1=2P2、n3<n2<3.2mol、Q3>2Q1,故答案为:ABD;
(4)t2时平衡向正反应方向移动,三氧化硫浓度增大,二氧化硫浓度减小,可减低温度或充入氧气能实现反应的转化关系,
故答案为:降低温度;充入氧气.
