为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如下图所示。
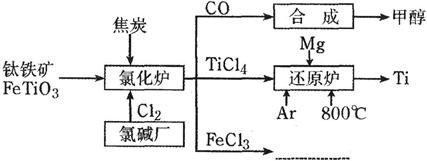
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用___________________;已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶6,则氯化炉中的还原剂化学式是________________________;
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s) △H=-641kJ•molˉ1
② 2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s) △H=-512kJ•molˉ1
则Ti(s)+2Cl2(g)= TiCl4(s) △H= ;
(3)Ar气通入还原炉中并不参与反应,通入Ar气的作用是_______________________;
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH+3O2+4OHˉ=2CO32ˉ+6H2O,该电池中负极上的电极反应式是:2CH3OH-12eˉ+16OHˉ=2CO32ˉ+12H2O。则正极上发生的电极反应为:___________。工作一段时间后,测得溶液的pH是____(填“减小”、“增大”或“不变”)。
(16分)(1)增大反应物间接触面积,提高反应速率2分) C、FeTiO3(4分,各2分,顺序不要求)
(2)-770kJ•molˉ1(2分,一定要标明单位)
(3)Mg和Ti都有强还原性,在Ar气氛中可防止被氧化(4分,前后回答准确各2分)
(4)①O2+2H2O+4eˉ=4OHˉ(或3O2+6H2O+12eˉ=12OHˉ)(2分) ②减小(2分)
题目分析:(1)联系影响化学反应速率的因素,钛铁矿是固体反应物,粉碎可以增大固体反应物的表面积,增大反应物之间的接触面积,提高化学反应速率;根据物质的量之比等于化学方程式的系数之比,则Cl2、C的系数分别为7、6,读图可知,氯化炉中氯元素由0降为—1价,则降低总数为1×2×7=14,碳元素由0升为+2价,升高总数为2×6=12,由于碳元素化合价升高总数不等于氯元素化合价降低总数,说明铁元素一定由+2升为+3价,且其系数为2,则该反应为2FeTiO3+7Cl2+6C=2TiCl4+2FeCl3+6CO,还原剂为FeTiO3和C;(2)观察已知热化学方程式,未知焓变的热化学方程式可以通过①×2–②得到,根据盖斯定律可知,△H=①的焓变×2–②的焓变=(-641kJ•molˉ1)×2—(-512kJ•molˉ1)=—770kJ•molˉ1;(3)还原炉中反应为2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s),Mg、Ti的还原性都强,容易被氧气、水、二氧化碳、氮气等气体氧化,降低钛的产率,而氩气是惰性气体,能防止镁、钛氧化,提高钛的产率;(4)正极上主要反应物和产物为O2→OHˉ;氧元素由0降为—2价,降低总数为4,则1个氧分子得到4个电子,即O2+4eˉ→OHˉ;根据左右电荷守恒原理,左边带4个负电,则右边一定为4个氢氧根离子,即O2+4eˉ→4OHˉ;根据左右原子个数守恒原理,右边比左边多4个H、2个O,说明左边还有2个H2O,即正极反应式为O2+4eˉ+2H2O=4OHˉ;O2+4eˉ+2H2O=4OHˉ中各微粒系数都乘以3,则3O2+12eˉ+6H2O=12OHˉ,也是该燃料电池的正极反应式;依题意,该燃料电池的总反应式为:2CH3OH+3O2+4OHˉ=2CO32ˉ+6H2O,工作一段时间后,氢氧根离子被消耗,且水的量增大,则氢氧根离子浓度一定减小,电解质溶液的碱性减弱,pH减小。
