问题
选择题
A、B、C为第2或第3周期的元素,A、B在同周期,A、C阴离子分别为A2-和C-,B2+ 和C-具有相同的电子层结构.下列说法中,正确的是( )
A.原子核外最外层电子数:A>C>B
B.离子半径:A2->C->B2+
C.B和C形成的化合物电子式为
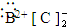
D.稳定性:H2A>HC
答案
A、B、C为第2或第3周期的元素,B2+ 和C-具有相同的电子层结构,则B在第3周期第ⅡA族,即B为Mg元素;C在第2周期第ⅤⅡA族元素,即C为F元素;A、B在同周期,A的阴离子为A2-,则A为S,
A.A为S,最外层电子数为6,B为Mg,最外层电子数为2,C为F,最外层电子数为7,原子核外最外层电子数:C>A>B,故A错误;
B.电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径:A2->C->B2+,故B正确;
C.B和C形成的化合物为MgF2,其电子式为
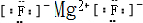
,故C错误;
D.非金属性C>A,则稳定性为HC>H2A,故D错误;
故选B.
