实验室用下列仪器和药品制取干燥纯净的氯气.
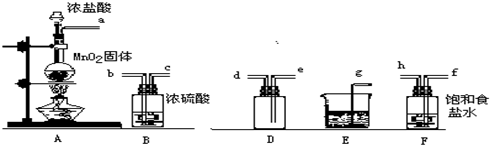
(1)按气流从左到右,装置正确的连接______接______接______接______接______接______接______接______(填各接口字母)
(2)装置F的作用是______,装置E的作用是______.
(3)装置A和E中的反应离子方程式为:A______;E______.
(4)若有17.4gMnO2参加了反应,将产生的氯气通入足量的KI溶液中能产生单质碘的物质的量为______.[相对原子质量:Mn-55 O-16].
(1)实验室制取氯气时,首先要制取氯气,然后要除去挥发出来的氯化氢气体,还要除去混入的水蒸气,这时得到了干燥、纯净的氯气,要用向下排空气法收集氯气,最后要吸收多余的氯气.即仪器连接顺序为:a接f接h接b接c接e接d接g.故答案为:a;f;h;b;c;e;d;g;
(2)制取氯气时需要加热,会使浓盐酸挥发出来,因此要用装置B除去HCl,可以使用饱和食盐水,即除去HCl又降低氯气在水中的溶解度;制取氯气时需要加热,会使浓盐酸挥发出来,因此要用装置B除去HCl,可以使用饱和食盐水,即除去HCl又降低氯气在水中的溶解度.故答案为:除去HCl 吸收多余的Cl2;
(3)装置A是浓盐酸与二氧化锰反应的容器,发生反应的化学方程式是MnO2+4HCl
MnCl2+Cl2↑+2H2O,其离子方程式是MnO2+4H++2Cl- △ .
Mn2++Cl2↑+2H2O. △ .
装置E中,要用氢氧化钠溶液吸收多余的氯气,氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠,所以氯气与氢氧化钠反应的化学方程式是CL2+2NaOH=NaCl+NaCl-+H2O,即离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O.故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;Cl2+2OH-=Cl-+ClO-+H2O; △ .
(4)n(MnO2)=
═0.2mol,根据MnO2+4HCl17.4g 87g/mol
MnCl2+Cl2↑+2H2O可知,2mol二氧化锰参加反应能生成0.2molCl2,根据Cl2+2KI=2KCl+I2可知,0.2molCl2反应能生成 △ .
0.2mol单质I2.故答案为:0.2mol.
