甲公司1999年至2005年发生有关经济业务。
(1) 1999年1月10日,甲公司销售一批商品给乙公司,货款为1531.8万元(含增值税额)。合同约定,乙公司应于1999年4月10日前支付上述货款。由于资金周转困难,乙公司到期不能偿付货款。经协商,甲公司与乙公司达成如下债务重组协议:乙公司以一批产品和一台设备偿还全部债务。乙公司用于偿债的产品成本为432万元,市场价格和计税价格均为540万元,未计提存货跌价准备;用于偿债的设备原价为1800万元,已计提折旧720万元,市场价格为900万元;已计提减值准备180万元。债务重组日为1999年12月31日。甲公司和乙公司适用的增值税税率均为17%。假定不考虑除增值税以外的其他相关税费。预计该固定资产尚可使用6年,净残值为零,采用直线法摊销。
(2) 2001年12月31日,由于与该固定资产相关的经济因素发生不利变化,致使其发生减值,甲公司估计可收回金额为420万元。
(3) 2003年12月31日,由于市场变化导致该固定资产2001的发生减值损失的不利经济因素全部消失,且估计此时其可收回金额为360万元。
(4) 假设甲公司为使产品进一步满足市场需要,适应新技术的发展,2004年底决定从 2004年12月31日起对该设备进行改造,A公司2005年1月到6月发生支出如下(单位:万元):
| 资产支出时间 | 资产支出金额 |
| 1月1日 | 525 |
| 2月1日 | 360 |
| 3月1日 | 420 |
| 4月1日 | 300 |
| 5月1日 | 270 |
| 6月1日 | 225 |
甲公司为该固定资产进行改造专门借入两笔款项:2005年1月1日发行3年期到期一次还本付息的公司债券,面值为1200万元,发行价格为1350万元,票面利率为8%,承销商按债券总面值1.5%收取手续费,直接从发行收中扣除。2005年4月1日与银行签订借款协议,借入一笔2年期借款900万元,年利率为5%。
(5) 改造工程于2005年6月30日完成并投入使用。企业当期没有其他购建的固定资产,按季计算应予资本化的借款费用金额。每月按30天计,债券溢价按直线法摊销。
要求:
(1) 编制甲公司1999年12月31日债务重组时的会计分录。
(2) 编制甲公司有关计提折旧和固定资产减值准备的会计分录。
(3) 编制甲公司有关改造的会计分录。
(4) 计算企业2005改造工程完工后固定资产的入账价值(按季计算应予资本化的借款费用)。
参考答案:会计分录(以万元为单位)
(1) 1999年12月31日债务重组时:
债权人甲公司受让非现金资产总入账价值=1531.80-540×17%=1440
甲公司受让设备的入账价值=1440×[900÷(540+900)]=900
甲公司受让商品的入账价值=1440×[540÷(540+900)]=540
借:固定资产 900
库存商品 540
应交税金——应交增值税(进项税额) 540×17%=91.8
贷:应收账款 1531.8
(2) 编制甲公司有关计提折旧和固定资产减值准备的会计分录。
①2000年、2001年每年计提折旧
借:制造费用 900÷6=150
贷:累计折旧 150
②2001年末提取减值准备
2001年末固定资产账面价值=900-150×2=600
2001年末可收回金额=420
2001年末计提的固定资产减值准备=600-420=180
借:营业外支出——计提的固定资产减值准备 180
贷:固定资产减值准备 180
③2002年、2003年折旧
借:制造费用 420÷4=105
贷:累计折旧 105
④2003年末转回减值准备
2003年末固定资产账面价值=900-150×2年-105×2年-180=210
2003年末不考虑计提减值因素下的账面净值=900-150×4年=300
2003年末确定转回的固定资产减值准备、累计折旧:
固定资产可收回金额为360万元与不考虑计提减值因素下的账面净值300万元;根据两者孰低原则以300万元作为比较基础:
确定转回的固定资产减值准备而冲减营业外支出的金额:该项固定资产的可收回金额与不考虑减值因素情况下的固定资产账面净值两者孰低确定的金额300-其账面价值210= 90
确定转回固定资产减值准备而恢复累计折旧的金额=计提减值准备后按不考虑减值因素情况下计提的折旧额150×2年-计提减值准备后重新计算确定的折旧额调整累计折旧 105×2年=90
借:固定资产减值准备 180
贷:营业外支出——计提的固定资产减值准备 90
累计折旧 90
⑤2004年计提折旧
借:制造费用 300÷2=150
贷:累计折旧 150
(3) 编制甲公司有关改造的会计分录。
2005年1月1日会计分录
①借:在建工程 150
累计折旧 150×5年=750
贷:固定资产 900
②第一季度应予资本化的借款费用的计算及账务处理
第一季度累计支出加权平均数的计算如下:
单位:万元
| 资产支出时间
填空题
|

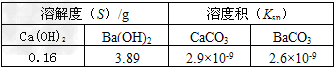
 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,氢气的反应速率v(H2)=
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,氢气的反应速率v(H2)=