问题
推断题
甲同学设计了以贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱的实验,过程如下。

① 高温煅烧贝壳时发生反应的化学方程式是 (6) 。
② 固体E的成分存在 (7) 种可能。为测定其成分,取少量固体E,放入足量稀盐酸中,有气泡产生,则固体E的成分是 (8) 。
③ 为得到较纯净的烧碱,乙同学提出了两个方案
方案一,除去固体E中的杂质:将固体E溶解,加入适量 (9) 溶液,过滤,将滤液蒸发结晶。
方案二,重新实验:通过称量固体 (10) 的质量,计算并加入适量纯碱。
答案
(6)CaCO3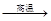 CaO + CO2↑; (7)3;
CaO + CO2↑; (7)3;
(8)碳酸钠、氢氧化钠;(2分) (9)氢氧化钙(氢氧化钡)
(10)贝壳和固体A
题目分析:高温煅烧贝壳时发生反应的化学方程式是碳酸钙高温分解,CaCO3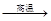 CaO + CO2↑,生成氧化钙和二氧化碳,A为氧化钙,B为二氧化碳,,氧化钙和水反应生成氢氧化钙,氢氧化钙和纯碱反应生成碳酸钙和氢氧化钠,固体C为碳酸钙,D中一定有氢氧化钠,还可能有碳酸钠,或者氢氧化钙,所以E的成分有三种可能氢氧化钠,氢氧化钠和碳酸钠,氢氧化钠和氢氧化钙,为测定其成分,取少量固体E,放入足量稀盐酸中,有气泡产生,说明其中有碳酸钠,所以E的成分为氢氧化钠和碳酸钠,除去固体E中的杂质即碳酸钠,将固体E溶解,加入适量的氢氧化钙,会将碳酸钙反应掉,生成氢氧化钠,不会引入新的杂质,方案二,重新实验:通过称量固体A的质量,计算并加入适量纯碱,即是加入的纯碱和氢氧化钙完全反应,最后溶液中只有氢氧化钠。
CaO + CO2↑,生成氧化钙和二氧化碳,A为氧化钙,B为二氧化碳,,氧化钙和水反应生成氢氧化钙,氢氧化钙和纯碱反应生成碳酸钙和氢氧化钠,固体C为碳酸钙,D中一定有氢氧化钠,还可能有碳酸钠,或者氢氧化钙,所以E的成分有三种可能氢氧化钠,氢氧化钠和碳酸钠,氢氧化钠和氢氧化钙,为测定其成分,取少量固体E,放入足量稀盐酸中,有气泡产生,说明其中有碳酸钠,所以E的成分为氢氧化钠和碳酸钠,除去固体E中的杂质即碳酸钠,将固体E溶解,加入适量的氢氧化钙,会将碳酸钙反应掉,生成氢氧化钠,不会引入新的杂质,方案二,重新实验:通过称量固体A的质量,计算并加入适量纯碱,即是加入的纯碱和氢氧化钙完全反应,最后溶液中只有氢氧化钠。
