铝和硅均能与强碱溶液反应,离子方程式分别为:
2Al+2OH-+2H2O====2 +3H2↑
+3H2↑
Si+2OH-+H2O====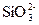 +2H2↑
+2H2↑
现有一铁、硅、铝的混合物13.0 g,当与足量盐酸反应时,生成标准状况下的氢气11.2 L;若将等质量的混合物与足量的NaOH溶液反应时,生成的H2在标准状况下也是11.2 L。求原混合物中各组分的质量。
13.0 g原混合物中Fe、Si、Al的质量分别为:4.31 g、1.08 g和7.62 g。
设13.0 g混合物中,Fe、Si、Al的物质的量分别是xmol、y mol、z mol,当与足量HCl(aq)混合时,Si不参加反应。
2Al+6HCl====2AlCl3+3H2↑
2 mol 67.2 L
z mol 33.6z L
Fe+2HCl====FeCl2+H2↑
1 mol 22.4 L
xmol 22.4x L
(横线上为求出数值,下同)
当与NaOH(aq)混合时,Fe不参加反应:
2Al ~ 3H2↑ Si ~ 2H2↑
2 mol 67.2 L 1 mol 44.8 L
z mol 33.6z L y mol 44.8y L
由题意得:
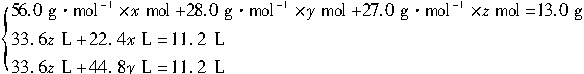 解得:x="0.076" 9、y="0.038" 5、z=0.282
解得:x="0.076" 9、y="0.038" 5、z=0.282
m(Fe)="56.0" g· mol-1×0.076 9 mol="4.31" g
m(Si)="28.0" g· mol-1×0.038 5 mol="1.08" g
m(Al)="27.0" g· mol-1×0.282 mol="7.62" g
