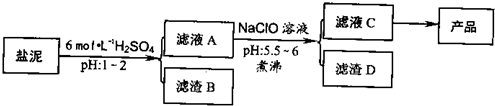
氯碱厂废渣(盐泥)中含有镁钙铁铝的硅酸盐和碳酸盐,其中含镁(以MgO计)约10%,钙(以CaO计)约15%,铁(Ⅱ、Ⅲ)和铝等的含量低于1%.氯碱厂从盐泥中提取MgSO4.7H2O的流程如下:
部分阳离子以氢氧化物沉淀时溶液pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| 温度0C | 10 | 30 | 40 |
| CaSO4 | 0.19 | 0.21 | 0.21 |
(1)滤渣B的主要成分是:______.
(2)从滤液A得到滤液C,能否用氨水代替NaClO?______,什么理由______,其中加热煮沸的目的是______.
(3)从滤液C中获得产品经过3个操作步骤,分别是______,______,______.
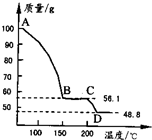
(4)将一定质量的MgSO4.7H2O放在坩埚中加热测得不同温度阶段剩余固体质量如图所示.
据图写出CD段反应的化学方程式______.
(1)在含有镁钙铁铝的硅酸盐和碳酸盐中加入硫酸可生成硅酸和硫酸钙沉淀,为H2SiO3(或H4SO4)\CaSO4(或CaSO4・2H2O),
故答案为:H2SiO3(或H4SO4)\CaSO4(或CaSO4・2H2O);
(2)从滤液A得到滤液C的目的是将Fe2+氧化成Fe3+,利用水解生成沉淀,而氨水不能将Fe2+氧化成Fe3+,则无法沉淀完全,NaClO起到氧化剂的作用,盐类的水解为吸热过程,加入促进水解生成沉淀并防止生成胶体,因加热有利于破坏胶体的稳定性,使沉淀颗粒变大利于后面过滤分离,
故答案为:否;氨水不能将Fe2+氧化成Fe3+,则无法沉淀完全; 加热能使Fe3+和Al3+水解完全,同时因为氢氧化铁和氢氧化铝是胶状沉淀,加热有利于破坏胶体的稳定性,使沉淀颗粒变大利于后面过滤分离;
(3)从滤液中获取晶体,应经过加热浓缩,冷却结晶,过滤等操作,故答案为:加热浓缩,冷却结晶,过滤; (4)100gMgSO4.7H2O中,m(MgSO4)=100×
=48.8g,m(H2O)=100g-48.8g=51.2g,120 246
则C点固体中含有水的质量为56.1g-48.8g=7.3g,此时n(H2O)=
=0.41mol,n(MgSO4)=7.3g 18g/mol
=0.41mol,48.8g 120g/mol
所以C点使固体的化学式为MgSO4•H2O,D点固体为MgSO4,则CD段反应的化学方程式为MgSO4•H2O
MgSO4+H2O↑, △ .
故答案为:MgSO4•H2O
MgSO4+H2O↑. △ .
