问题
实验题
在研究酸和碱的化学性质时,某小组同学想证明:稀硫酸与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。请与他们一起完成实验方案的设计、实施和评价。
(1)方案一:①测定稀硫酸与NaOH溶液混合前后的pH。测定某NaOH溶液的pH,pH 7(选填“<”“>”或“=”)。
②将一定量的稀硫酸加入该NaOH溶液中,混合均匀后测定其pH,pH<7。
③结论:稀硫酸与NaOH溶液发生了化学反应,并且 过量。
(2)方案二:观察 。(根据图示实验步骤,概括方案要点)
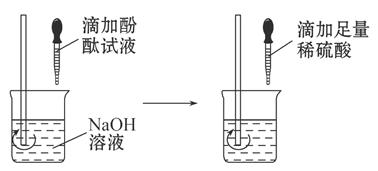
结论:稀硫酸与NaOH溶液发生了化学反应,反应的化学方程式为 。
(3)上述两个方案在设计思想上的相同点是 。
答案
(1)①> ③稀硫酸
(2)稀硫酸加入滴加酚酞试液的氢氧化钠溶液是否有颜色的改变 H2SO4+2NaOH=Na2SO4+2H2O
(3)测定溶液反应前后的酸碱性变化来确定两种溶液混合后是否发生了化学反应
(1)由于NaOH溶液呈碱性,故pH>7;pH<7,说明溶液呈酸性,稀硫酸过量。
(2)这是考查酸、碱是否反应的题目,由于硫酸与氢氧化钠反应没有现象,根据图示,需要借助酸碱指示剂的颜色变化来判断。
(3)方案一是测定溶液的pH来确定溶液酸碱性变化,方案二通过酸碱指示剂的颜色变化确定溶液的酸碱性变化,即都是测定溶液的酸碱性变化来判断反应是否发生。
