问题
计算题
某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0 g石灰石样品,把25.0g质量分数为10%的稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:

请计算:
(1)2.0g石灰石样品中碳酸钙的质量为 ,石灰石中碳酸钙的质量分数为 。
(2)请你继续计算反应生成溶液中氯化钙的质量分数(计算过程和结果均保留一位小数)。
答案
(1)1.7g;85%
(2)设反应生成CaCl2的质量为x,CO2的质量为y
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 111 44
1.7g x y
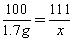

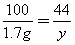
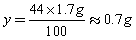
反应后溶液的质量:1.7g+25g -0.7g =26g
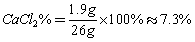
答:(1)石灰石样品中碳酸钙的质量分数为85%;
(2)反应生成溶液中氯化钙的质量分数为7.3%。
