问题
计算题
煤是重要的化工原料,用煤作燃料,不仅是极大的浪费,而且因煤中含有硫,燃烧后生成的二氧化硫会造成空气污染,某工厂用煤作燃料,每天燃烧含硫2%的煤4.8×l03kg。
(1)试计算每天该厂排放到空气中的二氧化硫为多少kg?
(2)该厂废气中二氧化硫的含量可根据下列反应测定:SO2+2H2O+I2==H2SO4+2HI。现取该厂废气样品500mL,用溶质的质量分数为2×10-9(即0.0000002%)的碘溶液200g与废气中的二氧化硫恰好完全反应,试计算该厂排放的废气是否符合国家规定的工业废气排放标准(废气中二氧化硫的含量不得超过0.15mg.m-3)。
答案
(1)解:4.8×l03kg煤中含S质量为4.8×103kg×2%=96kg
设生成的二氧化硫的质量为x
S+O2 SO2
SO2
32 64
96kg x
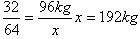
(2)200g碘溶液中I2的质量为200g×2×10-9=4×10-7g=4×10-4mg
设500mL样品中SO2质量为x
SO2+2H2O+I2==H2SO4+2HI
64 254
x 4×10-4mg
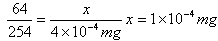
样品中SO2的含量为
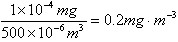
因为0.2mg·m-3>0.15mg·m-3,故不符合。
