问题
计算题
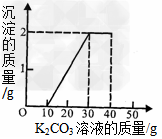
某班同学完成制取二氧化碳的实验后,对回收的盐酸和氯化钙混合溶液(不考虑其他杂质)进行了以下实验:取40mL该溶液于烧杯中,滴入40g溶质质量分数为13.8%的K2CO3溶液.滴入K2CO3溶液质量与生成沉淀质量的关系如图所示.求:
(1)所取40mL溶液中HCl和CaCl2的质量.
(2)实验结束后,若将烧杯中的物质蒸干,得到固体的质量.
答案
解:(1)从图象中的数据可以看出,10克之前没有出现沉淀,所以和盐酸反应的碳酸钾是10克,从10开始出现沉淀,到30沉淀不变,说明和氯化钙反应的碳酸钾是20克,生成沉淀是2克,设和碳酸钾反应的盐酸是x,生成氯化钾为y
K2CO3+2HCl = 2KCl+H2O+CO2↑
138 73 149
10×13.8% x y
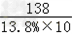 =
=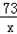 =
=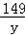
x=0.73克 y=1.49克
所以HCl质量为0.73g,
设和碳酸钾反应的氯化钙为a,生成氯化钾为b,生成的碳酸钙质量为c
K2CO3 + CaCl2 = 2KCl+CaCO3↓
138 111 149 100
20×13.8% a b c
 =
=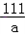 =
=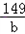 =
=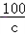
a=2.22克 b=2.98克 c=2g
所以CaCl2的质量为2.22g.
(2)1.49g+2.98g+13.8%×10g+2g=7.85g.
答:所取40mL溶液中HCl和CaCl2的质量分别是0.73g,2.22g;得到固体的质量是7.85g.
