问题
计算题
已知相对原子质量:Li 为6.9;Na 为23;K为39;Rb 为85.今有某碱金属M及其氧化物M2O组成的混合物10.8g,加足量水充分反应后,溶液经蒸发和干燥得固体16g.据此可确定金属M为何种元素?(提示:2M+2H2O=2MOH+H2↑)
答案
解:设金属M的相对原子质量为a,
若10.8g混合物全为M,由M~MOH的关系可知:可产生MOH的质量为10.8×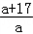 g,
g,
若10.8g混合物全为M2O,则有:
M2O~2MOH
2a+16 2(a+17)
可知产生MOH的质量为10.8×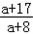 g<16g<10.8×
g<16g<10.8×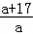 g,即:
g,即: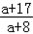 <
<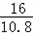 g<
g<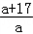 g
g
为计算方便取为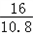 为
为  ,代入不等式,解得:10.7<a<35.3,
,代入不等式,解得:10.7<a<35.3,
因此M为Na元素(相对原子质量为23)
