(11分)某实验小组的同学为探究Na2O2与SO2的反应,用下图所示装置进行实验。通入SO2气体后,将带火星的木条插入试管C中,木条复燃。
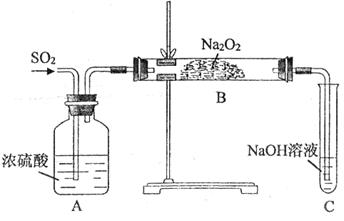
请回答下列问题:
(1)A装置中浓硫酸的作用是__________。
(2)部分同学依据 和
和 的反应,用类比的方法推理
的反应,用类比的方法推理 与
与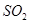 反应的固体产物为__________。另一部分同学依据
反应的固体产物为__________。另一部分同学依据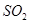 的强还原性和
的强还原性和 的强氧化性,猜想产物中含有
的强氧化性,猜想产物中含有 。为检验生成物中是否存在
。为检验生成物中是否存在 ,他们设计了如下实验方案:
,他们设计了如下实验方案:

请判断上述方案是否合理__________,简要说明理由:__________。
(3)向 溶液中缓慢通入
溶液中缓慢通入 气体,请分析通入
气体,请分析通入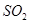 物质的量与溶液中溶质组成的关系,填写下表空格。
物质的量与溶液中溶质组成的关系,填写下表空格。
 的范围 的范围 | 溶液中溶质的化学式 |
| (0,0.5) | __________ |
| __________ |  、 、 |
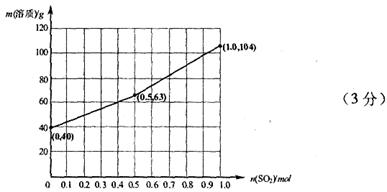
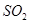 物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)
物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)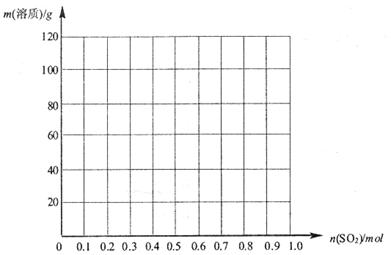
(1)干燥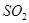 (1分)
(1分)
(2) (1分);不合理(1分),
(1分);不合理(1分),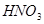 可将
可将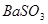 氧化为
氧化为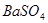 或过量的
或过量的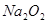 可将
可将 氧化为
氧化为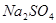 (1分)
(1分)
(3)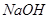 和
和 (2分);(0.5,1.0)(2分)
(2分);(0.5,1.0)(2分)
(1)由于SO2中含有水蒸气,而水也能和过氧化钠反应,所以浓硫酸的作用是干燥SO2。
(2)过氧化钠和CO2的生成物是碳酸钠和氧气,据此类推SO2和过氧化钠反应的固体生成物应该是Na2SO3。由于稀硝酸具有氧化性,能把BaSO3氧化生成BaSO4,其次过量的过氧化钠也能把Na2SO3氧化生成Na2SO4,因此是不合理的。
(3)氢氧化钠和SO2反应的方程式为2NaOH+SO2=Na2SO3+H2O、NaOH+SO2=NaHSO3。因此根据方程式可知,如果SO2的物质的量小于0.5mol,则溶液中的溶质就是NaOH和Na2SO3;如果SO2恰好是0.5mol,则溶质只有Na2SO3;如果SO2的物质的量大于0.5mol,而小于1.0mol,则溶质是Na2SO3和NaHSO3;如果SO2恰好是1mol,则溶质只有NaHSO3。由于氢氧化钠和SO2都是1mol,所以氢氧化钠是40g,最多生成亚硫酸钠是63g,亚磷酸氢钠是104g,图像见答案。
