资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为________________。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | ①气体成分为________ |
| 实验Ⅲ | ②取实验Ⅰ中的白色不溶物,洗涤,加入足量________ | ③________________ __________________ __________________ | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | ④溶液中存在________ |
(3)为进一步确定实验Ⅰ的产物,设计定量实验方案,如图所示:
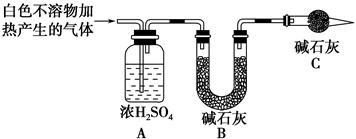
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重1.8 g,装置B增重8.8 g,试确定白色不溶物的化学式:__________________________ ______________________________________________。
(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:____________________________________。
(1)Mg(OH)2
(2)①氢气 ②稀盐酸(合理均可) ③产生气泡,沉淀全部溶解 ④CO32—
(3)2MgCO3·Mg(OH)2或Mg(OH)2·2MgCO3或Mg3(OH)2(CO3)2
(4)NaHCO3溶液中存在平衡:HCO32—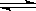 H++CO32—、H2O
H++CO32—、H2O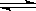 H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32—反应生成难溶物Mg(OH)2·2MgCO3,则H+、OH-、CO32—的浓度均减小,促使上述两平衡均向右移动
H++OH-;Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32—反应生成难溶物Mg(OH)2·2MgCO3,则H+、OH-、CO32—的浓度均减小,促使上述两平衡均向右移动
(1)镁与饱和碳酸氢钠溶液的反应,生成H2和白色不溶物,白色不溶物可能是Mg(OH)2或MgCO3或[xMgCO3·yMg(OH)2]。(2)能安静燃烧、产生淡蓝色火焰的是氢气;MgCO3中加入稀盐酸,沉淀全部溶解,产生气泡;加入氯化钙溶液,有白色沉淀生成,证明含有CO32—。(3)浓硫酸增重说明生成物中有H2O,碱石灰增重说明生成物中有CO2,且Mg(OH)2与MgCO3的物质的量之比为1∶2。(4)溶液中存在HCO3—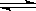 H++CO32—和H2O
H++CO32—和H2O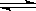 H++OH-,Mg与H+反应生成H2和Mg2+,Mg2+与CO32—、OH-反应生成沉淀Mg(OH)2·2MgCO3,两平衡均正向移动。
H++OH-,Mg与H+反应生成H2和Mg2+,Mg2+与CO32—、OH-反应生成沉淀Mg(OH)2·2MgCO3,两平衡均正向移动。
