如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加2滴浓盐酸后,立即用另一培养皿扣在上面.
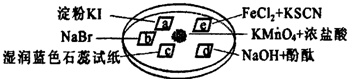
已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O对实验现象的“解释或结论”正确的是:
(1)a处变______色,b处变______色;
(2)c处的现象为______,请说明原因______;
(3)e处变______色,反应的离子方程式为______、______;
(4)近年来科学家提出,高铁酸钾(K2FeO4)也可用作水处理剂.可用FeCl3与KClO在强碱性条件下反应制取,其反应的离子方程式为(不需要配平)______.
(1)Cl2分别与KI、NaBr作用生成I2、Br2,a处变蓝、b处变橙色,故答案为:蓝;橙;
(2)氯气与水反应Cl2+H2O=H++Cl-+HClO,H+使试纸变红,HClO具有漂白性,可使试纸褪色,则C处先变红,后褪色,故答案为:先变红后褪色;Cl2+H2O=H++Cl-+HClO;H+使试纸变红,HClO使试纸褪色;
(3)Cl2将Fe2+氧化为Fe3+,试纸变为红色,反应的离子方程式2Fe2++Cl2=2Fe3++2Cl-;Fe3++3SCN-=Fe(SCN)3,
故答案为:红;2Fe2++Cl2=2Fe3++2Cl-;Fe3++3SCN-=Fe(SCN)3;
(4)用FeCl3与KClO在强碱性条件下反应制取K2FeO4,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
