某同学设计如下实验,测定Na2CO3、NaHCO3和CaCO3固体混合物中钠元素的质量分数.实验过程如下图所示:
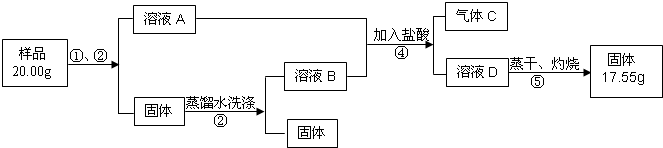
请回答:
(1)操作①、②的名称依次为______,_______.
(2)原样品中钠元素的质量分数为______.
(3)若测定结果偏低,原因可能是______(填字母).
a.溶液D中含有Na2CO3;b.溶液D中含有NaCl
c.操作③中固体没有洗涤干净;d.操作④中加入盐酸的量不足.
(1)通过溶解把碳酸钙与溶液初步分离,然后经过过滤除去混合物中的碳酸钙;
(2)所得17.55g氯化钠中钠元素的质量=17.55g×
×100%=6.90g23 58.5
原样品中钠元素的质量分数=
×100%=34.5%6.90g 20.00g
(3)a、由于碳酸钠中钠元素质量分数大于氯化钠中钠元素质量分数,因此溶液D中含有Na2CO3被当作NaCl计算,使得所计算的钠元素质量偏低;造成测定结果偏低;
b、溶液D为反应后的氯化钠溶液,因此溶液D中一定含有NaCl,此对测定结果不产生任何影响;
c、过滤后的碳酸钙表面附有溶液,若在操作③中固体没有洗涤干净,会使得溶液中碳酸钠、碳酸氢钠质量偏小,造成测定结合偏低;
d、操作④中加入盐酸的量不足,会使溶液D中含有未完全反应的碳酸钠和碳酸氢钠,灼烧后碳酸氢钠变成碳酸钠,结果和a情况一致,造成测定结果偏低;
故答案为:(1)溶解;过滤;(2)34.5%;(3)acd.
