Ⅰ.请把符合要求的化学方程式的字母填在下列空白处:
①既属于分解反应,又属于氧化还原反应的是______.
②属于分解反应,但不属于氧化还原反应的是______.
③既属于化合反应,又属于氧化还原反应的是______.
④属于化合反应,但不属于氧化还原反应的是______.
⑤不属于四种基本反应类型的氧化还原反应的是______.
A.(NH4)2SO3
2NH3↑+H2O+SO2↑ 加热 .
B.2CO+O2
2CO2 点燃 .
C.2C+SiO2
Si+2CO↑ 高温 .
D.NH4NO3
N2O+2H2O 加热 .
E.CaCO3+CO2+H2O=Ca(HCO3)2
F.MnO2+4HCl(浓)
MnCl2+H2O+Cl2↑ 加热 .
Ⅱ.(1)在一定条件下可以进行如下反应:8H2O+5R2O8n-+2Mn2+=2MnO4-+10RO42-+16H+,又知该反应中氧化剂与还原剂的物质的量之比为5:2,则R2O8n-中n的值为______.
(2)反应 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 可用于实验室制取氯气.
①用单线桥表示出该反应的电子转移情况:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
②在标准状况下,该反应产生2.24L Cl2时,消耗氧化剂______mol,被氧化的物质的质量为______ g.
Ⅰ、A、(NH4)2SO3
2NH3↑+H2O+SO2↑,属于分解反应,不是氧化还原反应; 加热 .
B.2CO+O2
2CO2;反应属于化合反应,是氧化还原反应; 点燃 .
C.2C+SiO2
Si+2CO↑;反应是置换反应,属于氧化还原反应; 高温 .
D.NH4NO3
N2O+2H2O;反应是分解反应,是氧化还原反应; 加热 .
E.CaCO3+CO2+H2O=Ca(HCO3)2 ;反应是化合反应,不是氧化还原反应;
F.MnO2+4HCl(浓)
MnCl2+H2O+Cl2↑;反应是氧化还原反应; 加热 .
故答案为:Ⅰ.①D ②A ③B ④E ⑤F
Ⅱ.(1)依据氧化还原反应的电子守恒计算,根据化合价升降分析,8H2O+5R2O8n-+2Mn2+=2MnO4-+10RO42-+16H+,该反应中氧化剂与还原剂的物质的量之比为5:2,标注化合价求化合价升降判断氧化剂还原剂,还原剂:2Mn2+~2MnO4-~10e-;氧化剂:5R2O8n-~10RO42-~(20-5n)e-,依据电子守恒得到:10=20-5n,n=2,故答案为:2;
(2)①用单线桥表示出该反应的电子转移情况为:
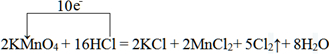
故答案为:
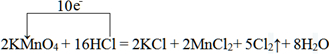
;
②反应为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O;在标准状况下,该反应产生2.24L Cl2时物质的量为0.1mol,氧化剂为KMnO4,2KMnO4~5Cl2,消耗氧化剂KMnO4为0.04mol;被氧化的物质为HCl,氧化剂和还原剂的定量关系为:2KMnO4~10HCl,所以被氧化的氯化氢物质的量为0.2mol,氯化氢的质量=0.2mol×36.5g/mol=7.3g;
故答案为:0.04;7.3.
