问题
问答题
氢氧化钠、氢氧化钡的固体混合物共21.1克,加入到一定质量的碳酸钠溶液中恰好完全反应,反应后过滤,得沉淀19.7克和12%的滤液,求:
(1)原混合物中氢氧化钠的质量?
(2)加入的碳酸钠溶液溶质质量分数多大?
答案
(1)根据题目信息可知,沉淀是碳酸钡,设氢氧化钡的质量为X,生成的氢氧化钠的质量是Y,碳酸钠的质量为Z.
Ba(OH)2+Na2CO3═BaCO3↓+2NaOH
171 106 197 80
x Z 19.7克 Y
═171 197 X 19.7克
得:X=17.1克
═106 197 Z 19.7克
得:Z=10.6克
═197 80 19.7克 Y
得:Y=8克
∴原混合物中氢氧化钠的质量=21.1克-17.1克=4克.
(2)根据以上计算,反应后溶液中氢氧化钠的质量=8+4=12克,所以滤液的质量=12÷12%═100克.根据质量守恒定律可知,碳酸钠溶液的质量=19.7克+100克-21.1克=98.6克,所以碳酸钠溶液溶质质量分数=
×100%═10.75%.10.6 98.6
答:原混合物中氢氧化钠的质量为4克,加入的碳酸钠溶液溶质质量分数为10.75%.

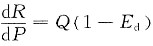 (其中R为收益),并用弹性Ed说明价格在何范围内变化时,降低价格反而使收益增加.
(其中R为收益),并用弹性Ed说明价格在何范围内变化时,降低价格反而使收益增加.