(3分) 化学兴趣小组对生铁样品中铁的质量分数进行探究。
【查阅资料】生铁中除铁外,还含有碳、硅、磷和硫等元素。碳在生铁中以两种形式存在:一种是单质碳(C),另一种是化合碳(如Fe3C);硅、磷、硫存在形式较为复杂;这些物质通常都不与稀硫酸发生化学反应。
【实验数据】
| 烧杯 | 烧杯+生铁样品 | 稀硫酸 | 烧杯+剩余物质 | |
| 质量/g | 70.4 | 102.4 | 247.3 | 348.7 |
(2)经质检部门精确测定,该样品中铁元素的总含量为95.2%(假设没有与硫酸反应的铁都是以Fe3C形式存在),求样品中Fe3C的质量分数。
(1)87.5% (2)8.25%
题目分析:(1)烧杯中反应前后减少的质量是逸出氢气的质量,利用铁和硫酸反应的化学方程式,根据氢气的质量可求出单质铁的质量,再根据 ×100%,求出生铁样品中单质铁的质量分数。
×100%,求出生铁样品中单质铁的质量分数。
解:根据质量守恒定律得,H2的质量=(102.4g+247.3g)-348.7g="1" g
设该生铁样品中单质铁的质量为x
Fe + H2SO4 FeSO4 + H2 ↑
56 2
x 1g
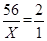
解得,X=28g
根据题意可知,样品的质量="102.4g" -70.4g="32" g ,
则Fe%=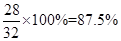
答:该生铁样品中单质铁的质量分数为87.5%
(2)样品的质量×样品中铁元素的质量分数=样品中铁元素的总质量,再用样品中铁元素的总质量-单质铁的质量,可求出Fe3C中的铁元素的质量,即32g×95.2%-28g=2.464g;
再根据Fe3C中铁元素的质量分数,求出Fe3C的质量,即2.464g÷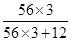 =2.64g;
=2.64g;
最后计算出样品中Fe3C的质量分数=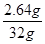 ×100%=8.25%
×100%=8.25%
答:样品中Fe3C的质量分数为8.25%
点评:根据化学方程式进行计算时,只要找准对应关系,计算正确即可,但要注意所使用的物质的质量应为参加反应的纯净物的质量,不可把混合物的质量直接代入进行计算。本题的第二小问比较难,做这类型题时应从问题着手倒着向前分析,直到出现已知条件。
