工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:
2FeSO4 ="===" Fe2O3 +SO2↑+SO3↑ 为检验FeSO4高温分解的产物,进行如下实验:
①取少量FeSO4高温分解得到的固体,加一定量稀盐酸溶解,向该溶液中加入适量的KSCN溶液,观察溶液颜色的变化以检验Fe3+是否存在。
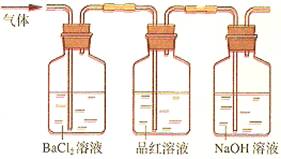
②将FeSO4高温分解产生的气体通入右图所示的装置中,以检验产生的气体中是否含有SO2和SO3。请回答以下问题:

(1)写出用KSCN检验Fe3+的离子方程式 。
(2)装置I中试剂为氯化钡溶液,进行操作②时氯化钡溶液中有白色沉淀产生。甲同学说,这个白色沉淀可能是BaSO4和BaSO3的混合物;乙同学说,这个白色沉淀是BaSO4;丙同学说,这个白色沉淀是BaSO3。请你设计一个简单的实验帮他们加以鉴别。
你认为上述哪一位同学的观点正确?
(3)装置II中试剂为品红溶液,其作用是 ,品红溶液中可观察到现象是 。
(4)装置III中试剂为NaOH溶液,其目的是 。
(1)Fe3++3SCN-=Fe(SCN)3
(2)取Ⅰ中白色沉淀,加入足量稀盐酸,若沉淀不溶解且无气泡产生,则沉淀为BaSO4
乙
(3)检验产生的气体中含SO2,品红溶液褪色
(4)除去多余的SO2,防止污染空气。
