(8分)化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸反应生成FeCl2还是FeCl3”。请你参与探究并回答有关问题:
(1)一位同学用在空气中向反应后的溶液中滴加NaOH溶液的方法来验证溶液中含有Fe2+。①可观察到整个过程的实验现象是______________,②加入NaOH溶液后,反应过程中发生反应的化学方程式是______________________和__________________。
(2)另一位同学向反应后的溶液中先滴加KSCN溶液,再向其中滴加新制氯水,溶液呈现红色,但当滴加过量新制氯水时,却发现红色褪去。为了弄清溶液红色褪去的原因,同学们查到如下资料:
Ⅰ.铁有一种化合物称为铁酸盐(含有Fe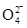 )。
)。
Ⅱ.SCN-的电子式为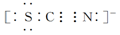
Ⅲ.氯水具有很强的氧化性。
于是同学们提出两种假设:
①第一种假设是:Cl2可将Fe3+氧化为Fe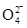 ,请写出该离子反应方程式________________________。
,请写出该离子反应方程式________________________。
②第二种假设是:__________________________。
(8分)(1)①产生白色沉淀,迅速变为灰绿色,最终变成红褐色
②FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O===4Fe(OH)3
(2)①2Fe3++3Cl2+8H2O===2Fe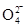 +6Cl-+16H+
+6Cl-+16H+
②SCN-被Cl2氧化 (方程式2分,其余每空1分)
(1)由于生成的氢氧化亚铁极易被空气氧化生成氢氧化铁,所以实验现象是首先产生白色沉淀,然后迅速变为灰绿色,最终变成红褐色。有关反应的方程式是FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O===4Fe(OH)3。
(2)①在反应铁元素的化合价从+3价升高到+6价,失去3个电子,而氯气只能得到2个电子,所以根据电子的得失守恒可知,反应的方程式是2Fe3++3Cl2+8H2O===2Fe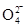 +6Cl-+16H+。
+6Cl-+16H+。
②根据SCN-的电子式可知,S和N元素的化合价分别是-2价和-3价,易被氯气氧化,因此红色也可以褪去。
