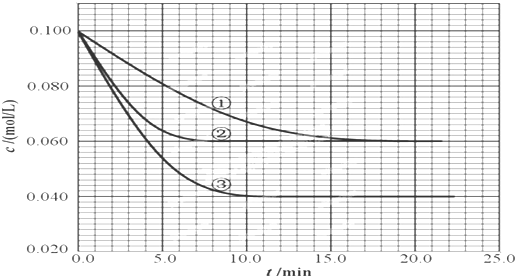
在2.00L的密闭容器中,反应2A(g)⇌B(g)+C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L.反应物A的浓度随时间的变化如下图所示:
请回答下列问题:
(1)以下说法能说明该反应已达到平衡状态的是:______(填序号)
①c(A):c(B):c(C)=2:1:1
②v(A)=2v(B)
③体系的压强不再改变
④A的质量分数不再改变
⑤混合气体的密度不再改变
(2)根据实验③回答:反应开始到4.0min时反应物A的转化率为______,B平均反应速率为______.
(3)与①比较,②和③分别仅改变一种反应条件.所改变的条件是:②______;③______.
(4)实验①条件下该反应的化学平衡常数值是______.若实验①到达平衡后,维持体系温度不变,往容器中再投入0.028molB和0.028molC,求新平衡时体系中A的物质的量浓度.(写出计算过程)
(1)①平衡时各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据,故错误;
②任何时候,v(A)=2v(B),不能作为判断达到平衡的依据,故错误;
③反应前后气体的化学计量数之和相等,压强不可作为判断的依据,故正确;
④A的质量分数不再改变,能作为判断达到平衡的依据,故正确;
⑤任何时候,混合气体的质量不再发生变化,容器的体积不变,导致混合气体的密度不再变化,所以不能作为判断达到平衡的依据,故错误;
故选:④;
(2)实验②平衡时B的转化率为
%=40%;0.04mol/L 0.1mol/L
2A(g)⇌B(g)+C(g)
初始 (mol/L) 0.1 0.02 0.02
转化 (mol/L) 0.04 0.02 0.02
4.0min(mol/L) 0.06 0.04 0.04
则B平均反应速率为
=0.005mol/(L•min),0.02mol/L 4.0min
故答案为:40%;0.005mol/(L•min);
(3)因催化剂能加快化学反应速度率,缩短达到平衡的时间,化学平衡不移动,所以②为使用催化剂;因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小,故答案为:加催化剂;温度升高;
(4)2A(g)⇌B(g)+C(g)
初始 (mol/L) 0.1 0.02 0.02
转化 (mol/L) 0.04 0.02 0.02
平衡(mol/L) 0.06 0.04 0.04
平衡常数表达式K=
=C(C)C(B) C2(A)
=0.04×0.04 0.062
;4 9
往体系中再投入0.028molB和0.028molC后,平衡向左移动,设转化的B的物质的量浓度为x
2A(g)⇌B(g)+C(g)
旧平衡(mol/L)0.0600.0400.040
新起始(mol/L)0.0600.040+0.0140.040+0.014
转化(mol./L)2xxx
新平衡(mol/L)0.060+2x0.054-x0.054-x
K=
=(0.054-x)2 (0.060+2x)2
x=0.006mol/L;4 9
再次达到平衡时A的物质的量浓度:c(A)=(0.060+0.006×2)mol/L=0.072mol/L;
故答案为:
;0.072mol/L.4 9
