某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下:
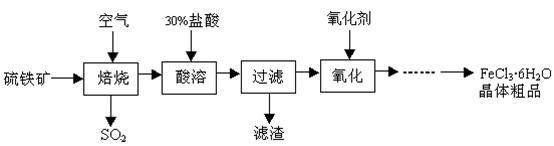
回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式 ;
(2)“酸溶”中反应的离子方程式为 ;
(3)“过滤”后滤液中金属阳离子有 ;
(4)“氧化”中使用的氧化剂最好是 ;
(5)该工艺流程中产生的SO2会污染空气并形成酸雨,下列物质:①BaCl2②品红③石灰乳 ④O2,用于吸收SO2最好的是 。
(1)3FeS2+8O2 Fe3O4+6SO2;(没配平扣1分,无高温不扣分。)
Fe3O4+6SO2;(没配平扣1分,无高温不扣分。)
(2)Fe3O4+8H+=2Fe3++Fe2++4H2O;(没配平扣1分,多写其它的离子方程式既不给分也不扣分。)
(3)Fe3+、Fe2+(各1分); (4)Cl2(H2O2等只要合理也可);(5)③
题目分析:(1)由题意可知硫铁矿中铁被氧化成了Fe3O4,可知反应式为3FeS2+8O2 Fe3O4+6SO2 ;
Fe3O4+6SO2 ;
(2)Fe3O4可溶解于盐酸中,反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O ;
(3)由Fe3O4的组成可知铁的化合价为+2和+3;
(4)氧化剂的加入是为了把其中的+2铁氧化成+3,只要不引入杂质即可,如Cl2、O3、H2O2 均可;
(5)吸收尾气SO2 工业上一般用碱性物质,如石灰乳。
