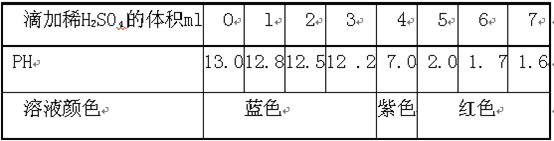
(5分)某同学进行中和反应实验:取适量的NaOH溶液于烧杯中,滴加几滴紫色石蕊试液.再逐渐滴加稀H2SO4测得溶液的PH及颜色变化情况如下表:
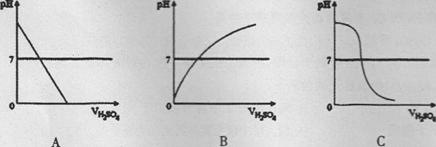
下图中符合上述实验过程的图形是___________
(2)当加人4ml稀H2SO4时,溶液显_______性,溶液中的溶质为_____________
(3)写出该中和反应的化学方程式________________________
(1)C (2)中 Na2SO4
(3)2NaOH+H2SO4=Na2SO4+2H2O
分析:氢氧化钠溶液呈碱性,其溶液的酸碱度大于7;硫酸溶液呈酸性,溶液的酸碱度小于7;二者进行混合时发生中和反应,混合溶液的酸碱度逐渐接近中性,在恰好完全反应时,所得溶液酸碱度恰好等于7为中性;随后加入的稀硫酸会使溶液的酸碱度逐渐减小.
解答:解:(1)由实验的数据表,该变化过程中溶液由碱性逐渐变成中性,待稀硫酸过量,溶液的酸性继续增大,溶液的酸碱度则继续减小;因此图C可以正确表示这一变化特点;
(2)当加入4mL稀H2SO4时,溶液酸碱度等于7,溶液呈中性,此时氢氧化钠与硫酸恰好完全反应,生成硫酸钠和水;故此时溶液中溶质为硫酸钠;
(3)氢氧化钠与硫酸发生中和反应,通过交换成分生成硫酸钠和水,反应的化学方程式为2NaOH+H2SO4═Na2SO4+2H2O.
故答案为:
(1)C;
(2)中;硫酸钠;
(3)2NaOH+H2SO4═Na2SO4+2H2O.
点评:酸碱中和时,溶液的酸碱度会随反应的不断进行而发生变化,明确两种溶液滴加顺利,对于判断溶液酸碱度变化的判断是关键.
