某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:
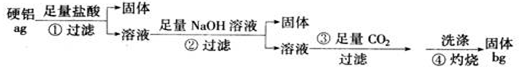
(1)补全上述①②③④各步反应的离子方程式
①Mg+2H+═Mg2++H2↑,______
②______,______Mg2++OH-═Mg(OH)2↓
③______CO2+H20+A102-═Al(OH)3↓+HCO3-
④2A1(OH)3═Al203+H20
(2)该样品中铝的质量分数是______
(3)第②步中加入Na0H溶液不足时,会使测定结果______
第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果______ 第④步对沉淀灼烧不充分时,会使测定结果______
A.偏高 B.偏低 C.不影响.
(1)第①步发生的化学方程式有两个:镁与盐酸反应,铝和盐酸反应,故答案为:2Al+6H+═2Al3++3H2↑;
第②步发生的化学方程式有三个:盐酸和氢氧化钠反应,氯化镁和氢氧化钠反应,氯化铝和过量氢氧化钠反应,
故答案为:H++OH-=H2O;Mg2++2OH-═Mg(OH)2↓;Al3++4OH-═AlO2-+2H2O;
第③步发生的化学方程式有两个:氢氧化钠和过量的二氧化碳反应,偏铝酸钠和过量的二氧化碳反应,离子反应为OH-+CO2=HCO3-,CO2+H20+A102-═Al(OH)3↓+HCO3-,
故答案为:OH-+CO2=HCO3-;
第④步发生的化学方程式只有一个:氢氧化铝加热分2A1(OH)3
Al203+H20. 加热 .
(2)因铝在反应前后守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,则铝的质量为
bg×
×100%,样品质量为ag,所以铝的质量分数为27×2 27×2+16×3
×100%,54b 102a
故答案为:
×100%;54b 102a
(3)因NaOH的量不足,铝不能完全转变成AlO2-,最终产生的氧化铝质量少,造成结果偏低,故选:B;
因不洗涤,固体表面有未反应的NaOH,会增加灼烧后固体的质量,造成结果偏高,故选:A;
因对沉淀的灼烧不充分时,有水分,则灼烧后固体的质量变大,会使测定的结果偏高,故选:A.
