问题
选择题
将相同质量的Na、Mg、Al、Zn、Fe分别投入足量的稀盐酸中,置换出的H2按由多到少的顺序排列正确的是( )
A.Zn>Fe>Na>Mg>Al
B.Al>Mg>Na>Fe>Zn
C.Na>Mg>Al>Fe>Zn
D.Fe>Zn>Mg>Al>Na
答案
答案:B
本题有以下3种解法。
方法一(设“一”法):设分别取Na、Mg、Al、Zn、Fe各1 g放入足量稀盐酸中。则:
(1)2Na+2H+ 2Na++H2↑
2Na++H2↑
46 g 2 g
1 g 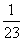 g
g
(2)Mg+2H+ Mg2++H2↑
Mg2++H2↑
24 g 2 g
1 g 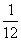 g
g
(3)2Al+6H+ 2Al3++3H2↑
2Al3++3H2↑
54 g 6 g
1 g 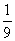 g
g
(4)Zn+2H+ Zn2++H2↑
Zn2++H2↑
65 g 2 g
1 g 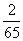 g
g
(5)Fe+2H+ Fe2++H2↑
Fe2++H2↑
56 g 2 g
1 g 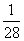 g
g
比较数的大小顺序便可得到答案。
方法二(排除法):在方法一中只进行前三种计算,便知答案。
方法三(摩尔电子质量法):对方法一进行总结,可以发现以下规律:
等质量金属与足量酸反应,金属的相对原子质量与反应后金属化合价的比值(即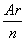 ,n为反应后金属的化合价)越小,生成H2越多;反应中,转移1 mol电子,需要金属的质量越小,等质量金属与酸反应生成H2越多。
,n为反应后金属的化合价)越小,生成H2越多;反应中,转移1 mol电子,需要金属的质量越小,等质量金属与酸反应生成H2越多。
