(7分)某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数。可供选用的试剂有:浓H2SO4、浓硝酸、6 mol·L-1 NaOH溶液。
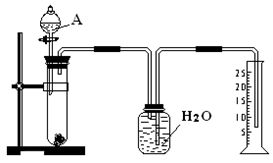
请填写下列空白:
(1)有关实验操作:a、往试管中放入适量的铝合金样品;b、从分液漏斗往试管中加入过量的A溶液;c、检查装置的气密性;d、测定收集到的水的体积。
正确的操作顺序为_______________________________(填字母)。
(2)A溶液可选用___________________________________________
(3)写出实验中发生反应的化学方程式:_________________________________________。
(4)若实验中测得样品的质量为Wg ,氢气的体积为a L(标准状况),则样品中Al的质量分数为_ __。
(1)c a b d (1分)
(2)6 mol·L-1NaOH溶液(2分)
(3)2Al + 2NaOH + 2H2O ="==" 2NaAlO2 + 3H2↑ (2分)
(4)9a/11.2W × 100% (2分)
(1)正确的操作顺序为c a b d;
(2)A溶液可选用:6 mol·L-1NaOH溶液,利用铝能与氢氧化钠溶液反应生成偏铝酸钠和氢气,而镁不能与氢氧化钠溶液反应;
(3)实验中发生反应的化学方程式为:2Al + 2NaOH + 2H2O ="==" 2NaAlO2 + 3H2↑;
(4)由方程式2Al + 2NaOH + 2H2O ="==" 2NaAlO2 + 3H2↑可得生成a L(标准状况)下氢气,需AL的质量为: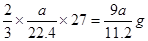 ;得样品中Al的质量分数为9a/11.2W × 100%
;得样品中Al的质量分数为9a/11.2W × 100%
