一定温度下,在2L密闭容器中NO2和O2可发生下列反应: 4NO2(g)+O2(g)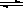 2N2O5(g)+5286 kJ已知体系中n(NO2)随时间变化如下表:
2N2O5(g)+5286 kJ已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
(1)能说明该反应已达到平衡状态的是 。
A.v(NO2)=4v(O2) B.容器内压强保持不变
C.v逆(N2O5)=2v正(O2) D.容器内密度保持不变
(2)反应达到平衡后,NO2的转化率为 ,此 时若再通入一定量氮气,则NO2的转化率将 (填“增大”、“减小”、“不变”)。
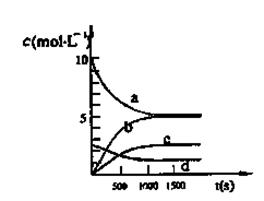
(3)图中能表示N2O5的浓度变化的曲线是 ,用O2表示从0~500s内该反应的平均速率v= 。
(4)能使该反应的反应速率增大,且平衡向正应方向移动的是 。
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
(1)B、C(2分)
(2)49.6% 不变 (2分)
(3)c 0.00151 mol·l-1·s-1 (2分)
(4)C (2分)
题目分析:(1)能说明该反应4NO2(g)+O2(g)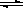 2N2O5(g)已达到平衡状态的是:A.v(NO2)=4v(O2)没有说明反应的方向,无法证明而C.v逆(N2O5)=2v正(O2)可以; B.由于该反应是一个体积发生变化的反应,如果没有达到平衡压强肯定发生变化,故容器内压强保持不变可以说明;D.容器内密度始终保持不变无法说明;故选BC。
2N2O5(g)已达到平衡状态的是:A.v(NO2)=4v(O2)没有说明反应的方向,无法证明而C.v逆(N2O5)=2v正(O2)可以; B.由于该反应是一个体积发生变化的反应,如果没有达到平衡压强肯定发生变化,故容器内压强保持不变可以说明;D.容器内密度始终保持不变无法说明;故选BC。
(2)根据表格可知1000S时反应达到平衡,已反应的NO2为:20mol-10.08mol=9.92mol,NO2的转化率为9.92/20×100%=49.6%;再通入一定量氮气,没有引起体系中4NO2(g)+O2 (g)⇌2N2O5(g)各物质浓度的变化,所以平衡不移动,转化率不变,故答案为:49.6%;不变;
(3)因反应物的浓度在减少,生成物的浓度再增加,根据方程式可知O2是NO2的反应速率的1/4,N2O5和NO2的反应速率的1/2,则a为NO2的变化曲线;c为N2O5的变化曲线,d为氧气的变化曲线,0~500s内反应的平均速率
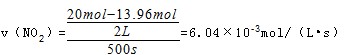 ,
,
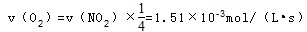 故答案为:c;1.51×10-3mol/(L•s)。
故答案为:c;1.51×10-3mol/(L•s)。
(4)A.及时分离出NO2气体平衡左移动,且速率减小,错误; B.适当升高温度速率增大但平衡左移,错误; C.增大O2的浓度满足,正确; D.选择高效催化剂不会使平衡移动,错误,故选C。
