将10.1克过氧化钠和钠的混合物跟120.1克水充分反应后,收集到的气体体积在标准状况下为2.24L。
(1)试分别写出过氧化钠跟水反应的离子、化学方程式 ;(2)计算原混合物中过氧化钠和氧化钠的物质的量之比,n(Na2O2):n(Na)= 。
(3)计算所得溶液的质量分数是多大?ω= 。
(1) 2Na2O2+2H2O=O2↑+4 NaOH、 2Na2O2+2H2O=O2↑+4OH-+4Na+
(2)1:1
(3)9.34℅
题目分析:(1)过氧化钠溶于水生成氢氧化钠和氧气,反应的化学方程式和离子方程式分别是2Na2O2+2H2O=O2↑+4 NaOH、2Na2O2+2H2O=O2↑+4OH-+4Na+。
(2)设过氧化钠和钠的物质的量分别是x和y,则78g/mol×x+23g/mol×y=10.1g。由方程式可知
2Na2O2+2H2O=O2↑+4 NaOH
2 2 1 4
x x 0.5x 2x
2Na+2H2O=H2↑+2NaOH
2 2 1 2
y y 0.5y y
所以0.5x+0.5y=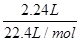 =0.1mol
=0.1mol
由78g/mol×x+23g/mol×y=10.1g可知x=y=0.1mol
原混合物中过氧化钠和氧化钠的物质的量之比,n(Na2O2):n(Na)=1:1。
(3)根据(2)中可知生成的氢氧化钠是2x+y=0.3mol
氢氧化钠的质量=0.3mol×40g/mol=12g
溶液的质量=10.1g+120.1g-0.05mol×32g/mol-0.05mol×2g/mol=128.5g
所以反应后溶液的质量分数ω=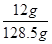 ×100%=9.34℅。
×100%=9.34℅。
